Пренатальное и постнатальное развитие и рост легкого. Анатомия и физиология дыхательной системы. В.М. Делягин.
Лёгкие приобретают привычные для нас форму, строение и адекватную функцию к 6-7 году жизни ребёнка. Но любое нарушение развития бронхов, бронхиол во внутриутробный период, в период родов или в период раннего детства существенно ограничивает функции лёгкого у ребёнка старшего возраста или взрослого. Нарушения развития могут быть обусловлены генетическим факторами, экзогенными (например, пассивное курение плода или новорождённого), вирусными инфекциями нижних отделов респираторного тракта, недоношенностью, искусственной вентиляцией и т.д.
В противоположность большинству других органов и систем, специфически функционирующих ещё в период внутриутробного развития, лёгкие как орган газообмена начинают функционировать только с рождения ребёнка. У плода будущее воздухоносное пространство лёгкого заполнено жидкостью. В момент первых вздохов оно буквально взрывным образом заполняется воздухом, и внутренняя поверхность лёгких вступает в свой постоянный контакте газовой средой. Точно так же резко фетальный тип кровообращения переводится на взрослый. Поэтому всё внутриутробное развитие лёгких нацелено на возможность перестройки типа дыхания и кровообращения. Для нормального газообмена после рождения ребёнка необходимо выполнить несколько условий:
создать широко разветвлённое дыхательное древо с мукоцилиарным механизмом самоочищения;
сформировать систему газообмена с большой поверхностью и эффективным барьером газ-кровь;
образовать поверхностную плёнку (сурфактант), препятствующую спадению лёгкого под действием поверхностного натяжения.
В лёгком можно принципиально выделить воздухопроводящие пути (трахея и бронхи) и область газообмена (паренхима лёгкого). В начале своего развития оба эти отдела неразличимы, в завершении они дифференцируются в морфологически и функционально специфические структуры. Из эмбрионального зачатка трахеи за счёт дихотомического деления возникает 16 поколений (генераций, уровней, порядков по разной терминологии) воздухопроводящих путей, которые завершаются терминальными бронхиолами. К терминальным бронхиолам примыкают в среднем 3 генерации респираторных бронхиол, затем - ductus alveolares (3 генерации) и, наконец, sacculus aLveolares (3 генерации).
В паренхиме дифференцируются эпителий дыхательных путей, соединительная ткань и капиллярная сеть будущих межальвеолярных перегородок. Капилляры теснейшим образом соприкасаются с плоским альвеолярным эпителием I типа, что минимизирует диффузионный барьер воздух-кровь. Его толщина составляет 0,05-0,25 мкм. Для функции газообмена чрезвычайно важна своевременная дифференцировка альвеолярного эпителия II типа, вырабатывающего сурфактант. Без сурфактанта паренхима лёгкого необратимо коллабирует на границе раздела газ-жидкость. В итоге у взрослого внутренняя поверхность лёгкого (совокупная поверхность альвеол) достигает 140 м2 (чуть меньше большого теннисного корта) при общем объёме лёгкого 4,5 л и числе альвеол - более 300 млн. Таким образом, внутренняя поверхность лёгких почти в 50 раз больше поверхности тела. Альвеолярная поверхность капилляров составляет 120 м2, ежедневный кровоток - 7000-8000 л, доля воздухоносного пространства в лёгком - 87%. На капилляры приходится 40% объема паренхимы. Эта потрясающая по своей сложности структура формируется с эмбрионального периода и до 2-3 летнего возраста качественно, проходя несколько стадий (табл. 1), чтобы затем начать количественный (линейный) рост.
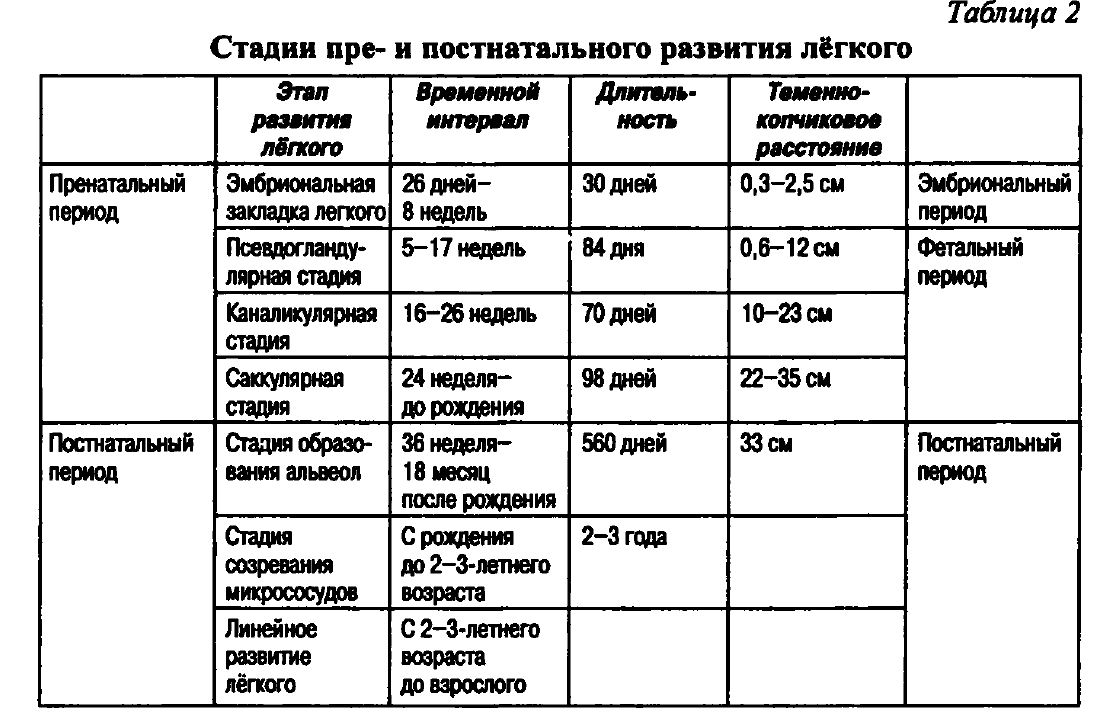
Временные границы отдельных стадий развития лёгкого относительны. В одном и том же лёгком в разных его участках в зависимости от их положения (краниально-каудально или центрально-периферически) могут одновременно протекать разные стадии развития (табл. 2).
Эмбриональная стадия - этап неспецифического развития лёгкого. Лёгкое формируется из энтодермального листка. Лёгкое закладывается и на первых этапах развивается как железистый орган. На 26 день после оплодотворения на передней кишке появляется вентральный дивертикул (лёгочная почка), который растёт в каудальном направлении в окружающую мезенхиму мезодермы. Между зачатком лёгкого и будущим пищеводом появляется желобок, который углубляется и формируется перегородка, отсутствующая в области будущего гипофаринкса.
Тут же после образования лёгочной почки она начинает делиться, так что к 32 неделе беременности определяются 5 маленьких мешочков, будущих глав-

ных и долевых бронхов и долей лёгкого. Начиная с 7 недели гестации, появляются субсегментарные веточки бронхиального дерева. В мезенхиме появляется и сосудистое сплетение.
Клиническое значение эмбриональной стадии заключается в возможном сохранении сообщения между трахеей и пищеводом в виде фистул. Частота трахеоэзофагеальных свищей составляет 1:3000-1:3500 живорождённых. Существует 5 вариантов атрезии пищевода и/или трахеоэзофагеальной фистулы. В 90% - это слепое завершение проксимальной части пищевода и трахеоэзофагеальная фистула с его нижним сегментом. Случаев агенезии лёгкого как следствия влияния тератогенных факторов мало, т.к. при раннем влиянии тератогенных факторов чаще происходит гибель эмбриона.
Псевдогландулярная стадия - промежуточный этап между эмбриональным и фетальным периодами. Указанная стадия известна как преацинарное деление воздухоносных путей и сосудов (Р. Jeffery е.а., 1994). Именно на этой стадии начинается собственно специфическое развитие лёгкого. В начале этой стадии лёгкое микроскопически выглядит как разветвлённая железа и мало напоминает будущее лёгкое, хотя морфологическая картина других органов в это время уже достаточно специфична. Железистые ходы построены из однорядного цилиндрического эпителия, высота которого убывает к периферии. Эли- телиапьные клетки, богатые гликогеном, формируют вначале небольшие, но со временем увеличивающиеся ходы. В конце псевдогландулярной стадии за счёт дихотомического деления возникают 16 новых генераций воздухопроводящих путей вплоть до преацинарных пространств. Общее число генераций бронхиального дерева достигает 20. В конце 10 недели в стенках бронхов появляются хрящи и гладкая мускулатура. Дифференцировка дыхательных путей протекает центрофугально. В центральных отделах лёгкого воздухопроводящие пути уже оказываются выстланы реснитчатым эпителием и бокаловидными клетками, а в периферических отделах сохраняется мало дифференцированный кубический эпителий. Неравномерность дифференциации имеет большое значение для роста лёгкого. Периферические недифференцированные ходы служат своеобразным «бором» при продолжающемся росте структур лёгкого и их внедрения в окружающую соединительную ткань.
Клиническое значение псевдогландулярной стадии достаточно велико. Нарушения развития лёгкого на этом этапе касаются, прежде всего, бронхов. Уменьшение числа бронхов приводит к гипоплазии лёгкого. Кроме того, на этой стадии происходит образование диафрагмы и полное разделение плевро-перитонеального канала. При неблагоприятных условиях формируются различной степени выраженности диафрагмальные грыжи, которые косвенно, за счёт сдавления лёгкого, приводят к его гипоплазии. Частота диафрагмальных грыж составляет 1:2000-1:3000 живорождённых.
Каналикулярная стадия характеризуется формированием контакта между эпителиальными канальцами и капиллярами. Мезенхима буквально пронизывается (канализируется) быстро растущими и вновь образующимися капиллярами. Расширяющиеся и быстро растущие тубулярные структуры прежней псевдогландулярной стадии внедряются в окружающую паренхиму и вступают в тесный контакт с капиллярами. Одновременно с этим начинается дифференцировка альвеолярного эпителия. Часть кубического эпителия незрелых тубулярных структур начинает уплощаться и образовывать альвеолярные эпителиальные клетки I типа. Эти клетки - предшественники тончайшего барьера газ-кровь. Другие клетки, сохраняя более или менее кубическую форму, начинают накапливать ламеллярные включения, являющиеся ничем иным как предшественниками сурфактанта. На стадии канали- кулярного развития впервые в околоплодных водах обнаруживается сурфактант. Только благодаря наличию плёнки сурфактанта на границе раздела будущей воздухоносной полости и поверхности альвеолы возможно расправление лёгкого при первом вздохе и невозможность коллабирования при выдохе. Сурфактанту человеческого плода начинает образовываться на 155- 160 день гестации, т.е. в начале 2-ой половины внутриутробного развития. V остальных млекопитающих сурфактант появляется после завершения 3/4 срока гестации.
Способные к делению клетки II типа служат предшественниками пневмоци- тов типа I и II. Клетки I типа, будучи чрезвычайно тонкими и сложно устроенными, к делению не способны. Начиная с 20 недели, иммуногистохимическими методами обнаруживаются и первые нейроэндокринные клетки. Наряду с дифференцированными клетками сохраняется недифференцированный кубический эпителий. Важнейшими итогами каналикулярной стадии является формирование контакта эпителия и капилляров и появление первых очагов функционально способной паренхимы.
Клиническое значение каналикулярной стадии - появление диффузионных возможностей и будущего формирования воздухоносного органа. По завершению этой стадии недоношенный может совершать газообмен и получает свой первый шанс на внеутробное существование. Нарушения, возникающие на этой стадии, затрагивают в основном структуры газообмена и заключаются в структурных изменениях паренхимы лёгкого. Уменьшение числа и объёма пространств газообмена выражается в гипоплазии легкого.
Саккулярная стадия характеризуется интенсивным развитием паренхимы лёгкого. За счёт дихотомического деления возникают последние генерации воздухоносных путей. После 3 поколений респираторных бронхиол появляются 3 генерации альвеолярных ходов. Их стенки являются первичными перегородками. В первичных перегородках всё ещё определяется большое количество соединительной ткани, хотя она быстро замещается сетью эластических волокон и капиллярной сетью. Паренхимы становится всё меньше, и контакт между капиллярами и эпителием становится теснее. Интенсивно продолжается дальнейшая дифференцировка эпителия. Только на периферии сохраняются небольшие участки кубического эпителия. В саккулярных образованиях начинается образование альвеол.
Клиническое значение саккулярной стадии. Большинство недоношенных с респираторным дистресс синдромом рождаются в период саккулярной стадии, когда образование альвеол только начинается. Тем не менее, лёгкое находится на такой степени зрелости, что недоношенный уже способен обеспечить себя кислородом. Нарушение развития лёгкого на последних неделях беременности приводит к незавершённости его созревания и уменьшению числа альвеол.
Функции лёгких у плода
Главная функция лёгких в период внутриматочного развития - образование жидкости, которая через трахею, рот и нос изливается в амниотическую полость или частично проглатывается. В экспериментах на овцах показано, что в лёгких образуется 15 мл жидкости на кг массы плода в час. Таким образом, лёгкие - важнейший источник амниотической жидкости (S. Tschanz u.a., 1999). В условиях усиленного дренажа жидкости развивается гипоплазия лёгкого с задержкой развития органа, снижением его массы и уменьшением числа генераций дыхательного аппарата. Такие же изменения наблюдаются у человека при маловодий. При атрезии трахеи, когда жидкость не покидает лёгкое, оно значительно расширяется, но созревание собственно лёгкого нарушается мало. Страдает синтез протеинов А, В и С сурфактанта. На развитии лёгкого сказывается секреция жидкости эпителием лёгкого, положительное давление за счёт голосовой щели и верхних дыхательных путей, адекватный объём внутригруд- ной и амниотической жидкости, дыхательные движения плода. Первые дыхательные движения начинаются в конце псевдогландулярной стадии развития. Денервация лёгкого с отсутствием нормальных дыхательных движений приводят к уменьшению его размеров на 60-70%.
Постнатальное развитие лёгкого начинается с взрывообразного изменения условий его существования. Жидкость в воздухоносных путях очень быстро замещается воздухом. Часть её регургитируется, основной объём резорби- руется в кровь и лимфу. Одновременно меняется соотношение потоков крови в большом и малом круге кровообращения. За счёт закрытия артериального протока и овального окна большая часть минутного объёма сердца поступает в малый круг кровообращения. Прирост объёма крови, протекающей через лёгкие, обеспечивается резким падением тонуса артерий.
В момент рождения лёгкое находится в самом начале стадии образования альвеол. Поэтому рождения ребёнка не означает смены одной стадии развития другой.
Стадия образования альвеол (с 36 недели гестации до 1,5-летнего возраста) начинается ещё внутриутробно, однако основная масса альвеол образуется после рождения. Из первичных перегородок, представляющих собой паренхиму, начинают вытягиваться вначале мелкие, а затем всё более заметные гребешки, называемые вторичными перегородками. И первичные, и вторичные перегородки имеют по два слоя капилляров, прилежащих к поверхности раздела газ-ткань. Таким образом, каждый из диффузионных барьеров имеет собственную капиллярную сеть. Между слоями капилляров располагается нежная соединительная ткань, представленная эластическими волокнами. Именно за счёт тяги этих волокон и появляются вторичные перегородки. В результате резко увеличивается внутренняя поверхность лёгких. Но вторичные перегородки появляются только в участках с двойным слоем капилляров. Вторичные перегородки формируются как складки одной из поверхностей первичной перегородки с принадлежащей ей капиллярной сетью. Соединительная ткань, расположенная между капиллярными сетями, постепенно истончается, так что капилляры в итоге очень тесно прилежат друг к другу. Последнее является условием для благополучного прохождения стадии созревания микрососудов, которая начинается вскоре после рождения ребёнка тут же после образования альвеол. К моменту рождения, по разным данным, имеется от 1х106 до 50х10б альвеол. У взрослых, в зависимости от размеров тела, их от 200x10* до 600x10*. Альвеолы формируются до 1,5-летнего возраста. Но подавляющее число альвеол появляется в первые б месяцев жизни ребёнка.
Стадия созревания микрососудов длится с рождения до 3-го года жизни и является последней стадией качественного роста лёгкого. Она тесно связана со стадией образования альвеол. В течение длительного времени эти две стадии в различных участках лёгкого протекают параллельно. Стадия созревания микрососудов приводит к образованию зрелых вторичных перегородок и завершает стадию образования альвеол. Первичные и вторичные перегородки, образующие альвеолы у плода, новорождённого и ребёнка грудного возраста, по своим морфологическим характеристикам не соответствуют зрелым межальвеолярным перегородкам взрослого. Незрелые межальвеолярные перегородки включают в себя большое количество соединительной ткани и двойную сеть капилляров. Важнейший этап трансформации перегородок - уменьшение количества соединительной ткани и истончение этих перегородок. По результатам морфометрических исследований показано, что после рождения, несмотря на интенсивный рост лёгкого, количество соединительной ткани в нём существенно уменьшается. Уменьшение объёма тканей происходит за счёт двух процессов: апоптоза и дегидратации межклеточного пространства. Близко расположенные капилляры двух параллельных сетей начинают сливаться. Резкое уменьшение толщины перегородок, сближение капиллярных слоёв и слияние капилляров приводит к резкому увеличению числа микрососудов в единице объёма ткани. Это является важнейшим условием массивнейшего кровотока при его тесном контакте с воздухом. По мере дальнейшей редукции соединительной ткани в межальвеолярных перегородках появляются т.н. коновские поры. Диаметр коновских пор составляет 2-13 мкм. В зрелой межальвеолярной перегородке взрослого насчитывается 5-7 пор. Фенестрация пор приводит к контакту альвеолярного эпителия типов I и II. Коновские поры служат для дополнительной циркуляции газов в патологических условиях не только по поверхности капиллярной сети, но и сквозь неё, из одной альвеолы в другую. В настоящее время доказано, что коновская пора в норме закрыта сурфактантовой плёнкой. Коновские поры - ворота для макрофагов, которые мигрируют из одной альвеолы в другую.
С завершением созревания микрососудов завершается и образование альвеол, хотя и у взрослого в небольшом количестве обнаруживают толстые перегородки с двойным слоем капилляров. В конце стадии созревания микрососудов морфология лёгкого ребёнка соответствует морфологии лёгкого взрослого человека. Межальвеолярные перегородки оказываются тонкими, с очень нежным каркасом соединительной ткани и густой сетью капиллярных петель, распространяющихся от одной поверхности перегородки к дру-
Клиническое значение постнатального развития лёгкого. В связи с тем, что образование альвеол тесно связано с созреванием микрососудов, нарушения развития лёгкого в этот период затрагивают обе эти стадии. Нарушение формирование альвеол происходит либо за счёт непосредственного патологического влияния, либо косвенно, за счёт нарушения созревания микрососудов. Например, назначение глюкокортикоидов способствует созреванию перегородок, но при этом не происходит образование новых перегородок и, соответственно, уменьшается число вновь образованных альвеол.
Рост лёгкого. На первом году жизни созревание и рост лёгкого протекают параллельно. Только после завершения созревания микрососудов начинается период линейного («простого») роста лёгкого. Выделяют ранний и поздний периоды роста лёгкого.
Ранний период длится от рождения до 3 лет. В этот период большинство параметров лёгкого по отношению к объёму лёгкого изменяется непропорционально. Прежде всего увеличивается объём пространства, задействованного в транспорте кислорода. Таю у ребёнка 1 месяца доля воздухоносного пространства в паренхиме составляет 75%, в 5 лет - 86%. Эти изменения происходят за счёт углубления воздухоносных полостей, увеличения высоты межальвеолярных перегородок без существенной перестройки паренхимы. Доля капиллярной крови в межальвеолярной перегородке по отношению к общему объёму перегородки у новорождённого составляет 12%, у 5-летнего - 37%, у взрослого - 42%. Эти изменения обусловлены созреванием и ростом капилляров. Указанные механизмы оригинальны. Из одной стенки капилляра к другой прорастает столбик соединительной ткани. Продлеваясь по длине капилляра, он разделяет поток крови в капилляре на 2 рукава. Такой тип роста капилляров был впервые описан в лёгком, но позднее обнаружен и в других органах, где требуется быстрое увеличение числа капилляров и плотности капиллярной сети. Увеличение доли воздухоносного пространства и объёма крови в паренхиме лёгкого идёт за счёт уменьшения объёма тканей. За первый год жизни доля ткани в межальвеолярных перегородках уменьшается с 23 до 14%. Уменьшение доли ткани происходит почти исключительно за счёт соединительной ткани: её доля снижается с 57 до 37%. Число пневмоцитов типов I и II и клеток эндотелия меняется несущественно.
Поздний период роста лёгкого начинается с 3 лет и длится до завершения роста костных структур грудной клетки. Лёгкое растёт в целом пропорционально общим размерам тела. Исключение составляет только объём крови в капиллярах, который и в позднюю фазу роста увеличивается с опережающей скоростью (с экспонентой 1,15) и определяет диффузионную способность.
Анатомия респираторной системы полностью подчинена физиологическим целям: газообмену. За те секунды, которые кровь проводит в капиллярной сети альвеол, она должна успеть насытиться необходимым кислородом и отдать углекислый газ, образовавшийся в организме в процессе метаболизма. Достаточно сказать, что при тяжёлой работе человек потребляет до 5 литров кислорода в минуту. Проблема газообмена может быть решена только одним путём: сочетать максимально возможную площадь газообмена в заданном объёме органа. Это достигается с помощью сильно разветвлённого бронхиального дерева, которое начинается с трахеи и после 23 ветвлений завершается в регионе собственно газообмена: в альвеолах. Макроскопическое деление лёгких на доли, сегменты и дольки соответствует генерациям бронхиального дерева: долевым, сегментарным бронхам и бронхиолам. Область газообмена начинается с первых альвеол в респираторных бронхиолах.
Трахея и два главных бронха связывают гортань с лёгкими. Передняя и боковые стенки трахеи и бронхов образованы подковообразными хрящами, соединёнными фиброэластической мембраной. Густая сеть коллагеновых и эластических волокон, образующих фиброэластическую мембрану, вертикально натянутую между хрящевыми полукольцами, обуславливает возможность изменения длины трахеи и бронхов. Благодаря мембране трахея и бронхи способные увеличиваться в длину на 50% своего первоначального размера. Задняя стенка построена из соединительной ткани и мышечной пластинки. Последняя образована гладкой мышцей М. trachealis, волокна которой лежат в поперечном направлении. Подковообразные хрящи трахеи и бронхов стремятся развернуться, а трахеальная мышца играет роль тетивы, удерживающей их и регулирующей диаметр трахеи и главных бронхов. При спокойном дыхании мышца напряжена. При форсированном дыхании тонус мышцы снижается, и диаметр трахеи увеличивается. Слизистая оболочка трахеи и бронхов плотно прилежит к их передней и боковым стенкам. На задней стенке она подвижна и при сокращении М. trachealis собирается в вертикальные складки. Диаметр проводящих дыхательных путей и их длина при прочих равных условиях (вязкость газа, природа воздушного потока) определяют сопротивление потоку воздуха. Во время спокойного дыхания воздушный поток, особенно в малых дыхательных путях, ламинарный. В таких случаях сопротивление пропорционально 4-х кратному радиусу просвета бронха. При высокой скорости потока он становится турбулентным, и сопротивление нарастает. Как видно из соотношения диаметра бронха и сопротивления потоку воздуха, даже небольшое изменение просвета бронха существенно повышает сопротивление дыханию. Этот феномен особенно выражен у новорождённых.
Респираторный эпителий трахеи состоит из многослойного призматического эпителия и представлен в основном базальными клетками, мерцательным эпителием и бокаловидными клетками. Наряду с этим имеется большое число эндокринных и нейроэндокринных клеток. Базальные клетки лежат на базальной мембране, но не достигают поверхности эпителиального слоя. В терминальных бронхиолах между реснитчатыми клетками вкраплены прозрачные клетки.
Они характеризуются высокой метаболической и секреторной активностью, играют роль стволовых клеток. С16 недели гестации обнаруживаются внутриэпителиальные лимфоциты. У взрослых в эпителии находятся и мастоциты, но у плодов их нет.
Все клетки лёгочного эпителия развиваются путём дифференциации и созревания примитивных энтодермальных клеток. Процесс протекает центрифу- гально: от крупных дыхательных путей к периферическим. Прозрачные клетки (безреснитчатые бронхиолярные клетки) развиваются во второй половине внутриутробного периода из примитивных безреснитчатых гликогенсодержащих клеток терминальных дыхательных путей. Созревание заключается в постепенной потере гранул гликогена, накоплении рибосом и появлении электронноплотных секреторных гранул. В гранулах содержится большое количество антипротеаз.
В проксимальных и дистальных воздухоносных путях по мере созревания лёгкого от фетального периода к постнатальному толщина клеточного уменьшается и нарастает относительный размер просвета бронха.
Дыхательные пути выстланы изнутри слоем секрета, образованного бокаловидными клетками, подслизистыми железами. Он - важнейший и защитный барьер и защитный механизм эпителия. Барьер - как слой и механизм - как способ очистки. Секрет не однородный, он устроен сложно. Секрет разделяется на два слоя. Пристеночно расположен жидкий водный слой (золь). Собственно секрет - верхний слой (гель), более плотный, вязкий. Золь состоит из секрета желёз, капиллярного транссудата, межтканевой жидкости и представляет собой раствор различных химических соединений. Эта жидкость имеет вязкость, сходную с вязкостью плазмы. Толщина слоя золя (водной гипофазы секрета) стабильна, т.к. она обеспечивает свободные колебательные движения ресничек. В составе геля, собственно секрета, основное значение принадлежит гликопротеинам, которые секретируются бокаловидными клетками. Кроме того, в состав геля входяттрансферрин, лизоцим, альбумин и другие соединения, выделяемые бокаловидными клетками и поступающие в результате транссудации из капилляров (иммуноглобулин А, сурфактант, комплекс липидов), играющие важную роль в адгезии секрета и сказывающиеся на структуре слизи. Все элементы связаны дисульфидными, ионными и другими связями. Гелевый секреторный слой находится на ковре из ресничек, погружённых в жидкую гипофазу (золь). Реснички мерцательного эпителия внедряются в водную гипофазу и своими колебательными движениями переносят расположенный на гипофазе слизистый слой в сторону глотки. Деление на водную гипофазу (золь) и слизистый слой (гель) имеет большое физиологическое значение. Незначительная вязкость гипофазы облегчает биение ресничек эпителия, а высокая вязкость слизистого слоя обуславливает захват и транспорт инородных частиц. Т.е. для мукоцилиарного клиренса необходимы хорошая работа ресничек и соответствующие реологические параметры секрета, прежде всего - вязкость и эластичность. Изменение двух последних величин тут же сказывается на мукоцилиарном транспорте: вязкий секрет невозможно продвинуть, жидкий - «работа вхолостую».
Вязкость и эластичность секрета зависят от количества воды и входящих в его состав гликопротеинов - муцинов. Муцины секрета принадлежат к двум различным подтипам: кислые муцины (сиало- и сульфомуцины) и нейтральные (фукомуцины). Сиаломуцины гидрофильны и составляют 55% всех гликопротеинов. Фукомуцины гидрофобны и составляют 40% всех гликопротеинов. Оставшиеся 5% приходятся на нейтральные гликопротеины - сульфомуцины. При различных патологических состояниях с нарушением секреции соотношение этих гликопротеинов меняется, но определяющим является концентрация сиало- и фукомуцинов. Снижение уровня сиаломуцинов сопровождается уменьшением водного компонента секрета, что характерно для большинства заболеваний органов дыхания, протекающих с нарушением секреции. Вместе со снижением уровня сиаломуцинов увеличивается количество фукомуцинов, отталкивающих воду. Всё это приводит к тому, что секрет становится вязким и густым. При общем снижении количества муцинов вязкость уменьшается. Патофизиологические, реологические и клинические проявления большинства заболеваний дыхательных путей и ЛОР-органов свидетельствуют о важности секреторных нарушений как патогенетического звена. Так, воспаление сопровождается гипертрофией, гиперплазией, гиперфункцией бокаловидных железистых клеток с усилением секреции слизи, уменьшением сиаломуцинов, значительным увеличением количества фукомуцинов, что приводит к повышению вязкости слизи. Последнее цедёт к застою, что, соответственно, способствует размножению бактерий. В этих условиях реснитчатый эпителий работает с усиленной нагрузкой, но не в состоянии обеспечить должный транспорт слизи. Длительная перегрузка приводит к истощению мукоцилиарного аппарата, дистрофии и атрофии эпителия. Хроническое воспаление, заболевания с интерстициальным компонентом, аутоиммунными реакциями сопровождаются уменьшением секреции слизи, уменьшением толщины водной гипофазы. При различных патологических состояниях вязкость и эластичность секрета меняются различным образом, и различные комбинации реологических параметров могут давать много разновидностей секрета, что требует осмысленного подбора муколитиков.
В собственной пластинке (Lamina propria) и частично между хрящевыми полукольцами располагаются многочисленные слизистые железы, где они могут простираться вплоть до адвентиции. У взрослых слизистые железы занимают до 12% площади стенки бронха, у детей - 17%. Т.е. гипертрофия слизистых желёз способна вызвать у детей значительно больше изменений, чем у взрослых (W. Field, 1968; К. Matsuba е.а., 1972). Железы закладываются в трахее на 10 неделе гестации. По мере развития лёгкого они концентрируются в области бифуркации бронхов и по переднебоковым стенкам.
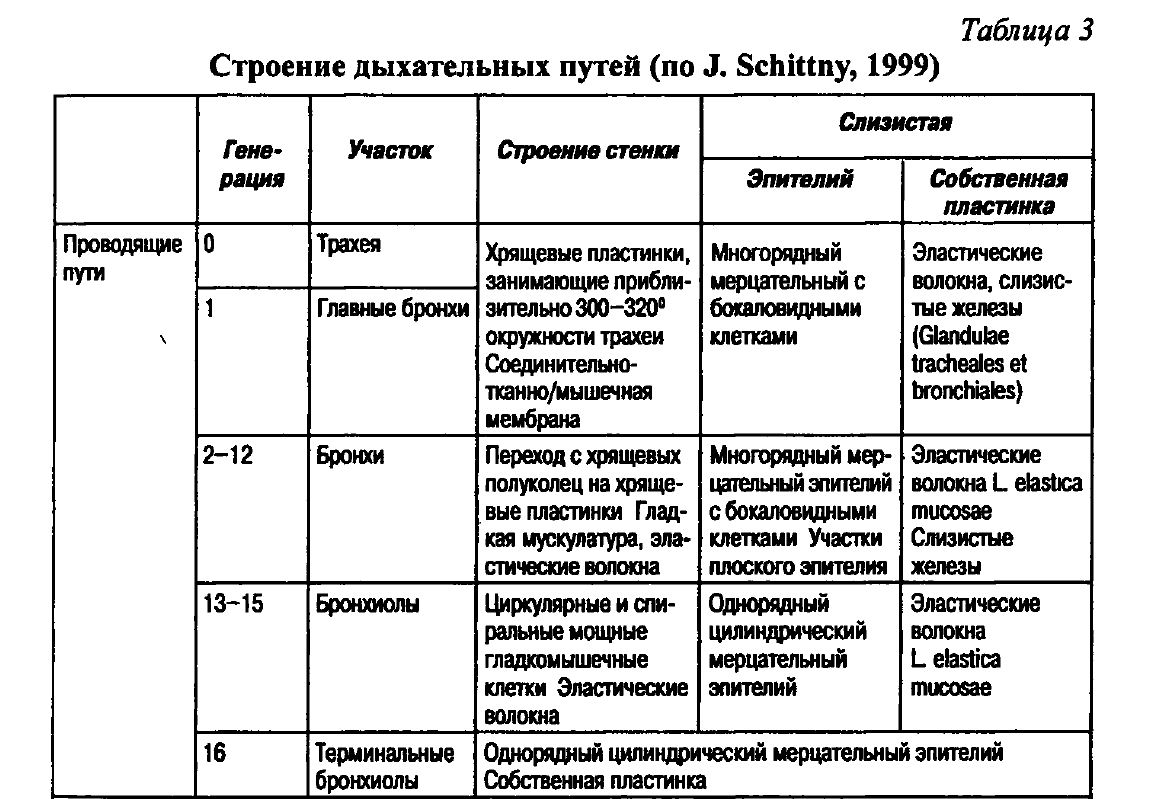
Строение респираторного тракта представлено в таблице 3.
Бронхи начинаются с участка бифуркации трахеи. Строение стенки главных бронхов соответствует строению стенки трахеи. Начиная с долевых бронхов, подковообразные хрящи начинают замещаться хрящевыми пластинками. Одновременно М. trachealis, расположенная в трахее по задней поверхности распространяется на всю окружность бронха, формируя Tunica musculans. Она ох-

ватывает весь бронх и обильно пронизана эластическими волокнами. Хрящевые элементы стенки бронха уменьшаются к периферии, одновременно нарастает число мышечных элементов. В мелких бронхах мышца становится основным составляющим элементом его стенки. Так, в бронхах гладкие мышцы занимают 3% стенки, в бронхиолах -10-20%. Мышечные пучки располагаются спирально, перекрещивая друг друга, пронизанные множественными эластическими волокнами.
Гладкие мышцы бронхов появляются на 6-8 неделе гестации. Спонтанные сокращения гладких мышц бронхов появляются в первом триместре беременности. К моменту рождения мышцы бронхов зрелые, иннервированы, способны к сокращению. У плода и ребёнка мышечная масса бронха относительно его размеров больше, чем у взрослого. У недоношенных мышечная масса бронхов относительно их размеров больше, чем у доношенных. У детей раннего возраста мышечная масса бронхов значительно увеличивается после искусственной вентиляции или постинфекционного бронхиолита (A. Hislop е.а., 1987; 1989).
Собственная пластинка слизистой содержит в L. elastica mucosae многочисленные эластические волокна, ориентированные по длине бронха. Бронхи, как и трахея, выстланы изнутри многорядным высокопризматическим мерцательным эпителием с включением базальных и бокаловидных клеток. В местах максимальных нагрузок в области бифуркации крупных бронхов, особенно в области бифуркации трахеи, мерцательного эпителия нет. Он заменяется многорядным плоским неороговевающим эпителием.
Переход от бронхов к бронхиолам трудноуловим и определяется исчезновением хрящевых пластинок и изменением эпителия. Давление воздуха в бронхиолах очень умеренное. Кроме того, их просвет по всем трём пространственным осям сохраняется за счёт натяжения соединительной ткани лёгкого. Поэтому стенка бронхиол, кроме слизистой оболочки, образована тонким слоем мышц и нежной адвентицией. Мышечные слои располагаются циркулярно и спиралеобразно и усилены эластическими волокнами. Эластические волокна связаны с мощными продольно расположенными волокнами Lamina elastica mucosa. Последние простираются до входа в альвеолы и образуют т.н. аксиальную соединительную ткань. Эластические волокна притягивают стенки бронхиол к соединительнотканным междольковым перегородкам и к плевре, т.е. к периферической соединительной ткани (покровная соединительная ткань). Эластическая тяга лёгочной ткани обуславливает открытие бронхиол в случае их коллапса. В противоположность этому сокращение мускулатуры в стенках и повышение давления паренхимы лёгких ведёт к закрытию просвета бронхиол. Причём особое значение имеет повышение паренхиматозного давления. Это случается при ранении лёгкого, накоплении жидкости в плевральной полости.
Клинически значимое изменение диаметра воздухоносных путей в зависимости от дыхания (уменьшение диаметра на выдохе и увеличение диаметра за счет тяги соединительной ткани расправляющихся лёгких) наблюдается только в бронхиолах и мелких бронхах. Диаметр средних и крупных бронхов при вдохе и выдохе меняется незначительно.
Бронхиолы выстланы однорядным кубическим мерцательным эпителием, между клетками которого находятся прозрачные клетки апокриновой секреции. Последние заменяют бокаловидные клетки, расположенные в более крупных воздухопроводящих путях.
Терминальными бронхиолами заканчиваются собственно воздухопроводящие пути, и начинается область газообмена. Появление первых альвеол - признак респираторных бронхиол. Альвеолы в виде полушарий прикреплены к стенкам бронхиол. Если альвеолы оказываются сгруппированными, их отделяет друг от друга только общая межальвеолярная (интеральвеолярная) перегородка. Межальвеолярные перегородки, густо пронизанные капиллярами, и внутриаль- веолярное пространство обозначаются как паренхима лёгких. Здесь и происходит газообмен.
В области газообмена (в респираторной зоне) выделяют три региона.
Bronchioli respiratorii, респираторные бронхиолы, представляют собой переходные структуры к собственно области газообмена. Они начинаются4 дистальнее терминальных бронхиол, ветвятся 1-3 раза, образуя респираторные бронхиолы 1-3 порядков (генерации). В их стенках появляются вначале отдельно расположенные альвеолы, ниже - группы альвеол, пронизывающих гладкую мускулатуру и слизистую оболочку стенки бронхиолы.
Ductus atveolares насчитывают 2-3 генерации и практически полностью усеяны альвеолами. Стенка альвеолярных ходов представляет собой, по сути дела, входы в альвеолы (альвеолярные кольца). Альвеолярное кольцо усилено мышечными и соединительнотканными волокнами.
Sacculi alveolares завершают дыхательные пути. Это мешочкообразные воздухоносные пространства, стенки которых образованы многочисленными альвеолами.
Отдельная терминальная бронхиола, завершающаяся респираторной бронхиолой, альвеолярные ходы (2-8) и альвеолярный мешочек образуют респираторный ацинус, диаметром около 1 см. Ацинус - базовая респираторная единица лёгкого.
Внутренняя поверхность респираторных бронхиол выстлана однорядным кубическим мерцательным эпителием с включением секреторных клеток. Клетки мерцательного эпителия прослеживаются вплоть до входа в альвеолы. В альвеолярных ходах и альвеолярных мешочках находятся только клетки альвеолярного эпителия. В области перехода от воздухоносных путей к собственно респираторному региону находится очень небольшое количество клеток щёточного эпителия (тип-Ш-пневмоцитов). На апикальной поверхности пневмо- цитов III типа циркуяярно сгруппированы микроворсинки, почему клетки и получили название щёточного эпителия. Щёточный эпителий теснейшим образом связан с нервными волокнами и рассматривается как механо- и/или хемо- рецепторный аппарат.
Альвеолы разграничиваются межальвеолярными перегородками, но этот барьер не является абсолютным. Зрелая альвеолярная перегородка содержит центральную капиллярную сеть и, в качестве несущего элемента, соединительную ткань. Каждый капилляр контактирует с двумя поверхностями межальвеолярной перегородки. На одной стороне диффузионный барьер построен из эпителия, базальной мембраны и эндотелия. На другой стороне диффузионный барьер оказывается чуть сложнее: к перечисленным структурам добавляется соединительная ткань. Поверхность альвеолярной перегородки выстлана тончайшей эпителиальной клеткой: эпителиальная клетка типа I. Между ними рассеяны альвеолярные макрофаги, осуществляющие иммунную защиту и клиренс мельчайших инородных тел.
Пневмоциттипа I происходят как из недифференцированных клеток, так и из пневмоцитов типа II. Пневмоциттипа I является высокоспециализированной клеткой, формирующей тончайшую поверхностную мембрану диффузионного барьера. Ядро клетки располагается между петель капиллярной сети и окружено тончайшим слоем цитоплазмы. Толщина клетки вне области расположения ядра составляет всего 0,05-0,2 мкм, длина достигает 50 мкм. В результате одна клетка покрывает 5000 мкм2 площади альвеолы. Эпителиальные клетки типа I (пневмоциты типа I), составляя всего 30% от общего числа альвеолярных клеток, занимают 97% площади альвеолы.
В диффузионном барьереапителий и эндотелий капилляров разделены только слившимися базальными мембранами. Общая толщина диффузионной мембраны составляет 0,2-0,4 мкм. Соединительная ткань расположена на противоположной стороне от капилляров, тесно связана с ними и образует опорный каркас межальвеолярной перегородки. Здесь путь газовой диффузии чуть длиннее, чем со стороны, где отсутствует слой соединительной ткани. Так как диффузия газов происходит с двух сторон мембраны, то средняя взвешенная толщина диффузионного барьера в самом тонком месте составляет 0,6 мкм. Диффузионный барьер включает в себя также сурфакгановую пленку на поверхности альвеолы и слой плазмы между стенкой капилляра и эритроцитами.
Выходу жидкости из капилляров препятствуют низкое давление в малом круге кровообращения (в б раза ниже, чем в системном кровотоке) и напряжение миофибробластов в интерстициальном пространстве. Последние контролируют комплайенс межклеточного пространства интеральвеолярных перегородок, повышая межклеточное давление и препятствуя тем самым экссудации.
Эпителиоциты типа II (пневмоциты типа II) рассеяны между клетками эпителия типа I. Их излюбленная локализация - в межкапиллярных петлях. Пнев- моциты типа II составляют 60-66% всех клеток альвеолярного эпителия, но покрывают только 7% поверхности альвеол. Пневмоциты типа II имеют округлую форму, цитоплазма сконцентрирована апикально. На верхушке клетки венчиком, окружая гладкое пространство, расположены микроворсинки, так что поверхность клетки напоминает тонзуру католического монаха. Пневмоциты типа II выполняют две важные биологические задачи. Во-первых, они являются стволовыми клетками для всех клеток альвеолярного эпителия. Во-вторых, они вырабатывают фосфолипиды и протеины сурфактанта.
Сурфактант - макромолекулярный комплекс фосфолипидов и гидрофобных протеинов. Наиболее крупные фосфолипидные компоненты - фосфатидилхо- лин (лецитин) и фосфатидилглицерол. Накопление лецитина в амниотической жидкости является показателем зрелости лёгкого и наличия достаточно большого количества сурфактанта для обеспечения спонтанного дыхания. До 32-й недели беременности, т.е. до образования альвеол, концентрация в амниотической жидкости лецитина (фосфатидилхолина) как показателя синтеза сурфактанта низкая (<3 мг%). С 32-й недели беременности концентрация лецитина в амниотической жидкости начинает резко увеличиваться. Лёгкое достигает зрелости при концентрации лецитина 10 мг%.
Синтез сурфактанта повышен в физиологических условиях у плодов женского пола, в патологических - при диабете матери, артериальной гипертензии, мальнутриции, токсемии, наркомании, предлежании плаценты, преждевременном разрыве плодного пузыря, задержке внутриутробного развития плода, гемоглобинопатии.
Синтез сурфактанта снижен в физиологических условиях у плодов мужского пола, в патологических - у престарелых беременных, при анемии, многоводии, гипотиреозе, изоиммунной болезни плода, болезнях печени и/или почек, сифилисе, токсоплазмозе.
Сурфактант образует поверхностно активную плёнку на внутренней поверхности лёгкого. Наряду с водной гипофазой он увлажняет эпителий, тем самым сохраняя его, и, самое главное, блокирует коллабирующее влияние поверхностного натяжения. Расправление легкого после рождения и его последующая стабильность возможны только при минимальном поверхностном натяжении. Одновременно сурфактант содействует уменьшению объёма лёгкого при выдохе. Чем больше заполнение альвеолы газом и, соответственно, увеличение её объёма, тем выше поверхностное натяжение. В максимально наполненной альвеоле плёнка сурфактанта истончена и не способна выдержать значительно наросшее поверхностное натяжение. Поверхностное натяжение внутренней поверхности альвеол существенно дополняет мышечный компонент выдоха. Лёгкое начинает спадаться до определённого объема, поверхностное натяжение падает, пленка сурфактанта утолщается и тормозит Дальнейшее коллабирование лёгкого. Снижение поверхностного натяжения при выдохе - эффективный механизм экономии механической энергии лёгкого.
Соединительная ткань лёгкого. Первые хрящи трахеи появляются на 4 неделе гестации, в главных бронхах - на 10-й неделе, в сегментарных - на 12-й неделе внутриутробного развития. На периферии лёгкого хрящи продолжают формироваться до 2 месяца после рождения ребёнка. Начиная с 3 месяца по- стпартальной жизни, число хрящей увеличивается очень незначительно, но существенно увеличиваются размеры и масса каждой хрящевой пластинки. В соединительной ткани собственно лёгкого условно выделяют 3 части:
Перибронхиальная и периартериальная соединительная ткань известна как аксиальная. Она окутывает бронхиальное дерево и лёгочную артерию. Аксиальная соединительная ткань всегда располагается в центре сегмента и оканчивается на уровне входа в альвеолу, где она контактирует с септальной соединительной тканью. Аксиальная соединительная ткань, наряду с коллагеновыми волокнами, содержит эластические волокна, доля которых возрастает к периферии. Соответственно меняется и биохимический состав хрящей. В проксимальной части бронхов хрящи гиалиновые, в мелких бронхах - эластические.
Периферическая соединительная ткань - покровная. Она сопровождает вены и лимфатические сосуды. Наиболее мощная покровная соединительная ткань образует висцеральную плевру и построена из 3 слоёв. Наружный слой плотных коллагеновых и эластических волокон является своеобразной капсулой для долей лёгкого. Средний слой плевры более рыхлый и несёт в себе кровеносные и лимфатические сосуды. От внутреннего плотного слоя в паренхиму легкого тянутся отдельные пучки, которые соединяются с межальвеолярными перегородками.
Септальная соединительная ткань - несущий каркас межальвеолярной перегородки. Она содержит большое количество эластических волокон и тесно связана с капиллярной сетью.
Все три компонента соединительной ткани лёгкого образуют единый комплекс. Септальная соединительная ткань связывает аксиальную и периферическую. Она сопрягает механическое напряжение между дыхательными путями и плеврой. В области альвеол эластические волокна лёгочного комплекса соединительной ткани принимают на себя приблизительно треть общей ретракцион- ной силы лёгких.
Межклеточный матрикс обеспечивает поддержку структур лёгкого и участвует в морфогенезе. Объём межклеточного матрикса резко увеличивается при бронхолёгочной дисплазии и дистресс синдроме новорождённых. В лёгких у таких детей существенно увеличивается концентрация ДНК, гидроксипролина и дес- мозина (J. Vesbo е.а., 1996).
Лёгкие снабжаются кровью из двух разных систем кровообращения.
Лёгочный круг кровообращения. Аа. pulmonales - результат деления Truncus pulmonalis на правую и левую лёгочные артерии. Они несут обеднённую кислородом кровь из правого предсердия в лёгкое. Кровь оксигенируется в капиллярах межальвеолярных перегородок и через Vv. pulmonales поступает в левое предсердие. Эта система кровообращения (малый круг кровообращения) служит для обеспечения организма кислородом и известна как Vasa publica.
Кровоснабжение собственно лёгких как органа через большой круг кровообращения проходит по т.н. бронхиальному кругу. Rr. bronchiales, ранее известные как Аа. bronchiales, и Vv. bronchiales являются артериями мышечного типа, принадлежат к большому кругу кровообращения и снабжают участки лёгкого, которые не получают непосредственно оксигенированную кровь из системы Vasa publica. Это относится к тканям лёгочной артерии, бронхов и бронхиол до терминальных включительно, перибронхиальным и периартериальным тканям. Rr. bronchiales располагаются в соединительной ткани перибронхиально. К каждому легкому подходит 1-3 Rr. bronchiales, ответвляющихся от 3-4 межрёберных артерий или непосредственно от аорты. Капиллярная сеть этих артерий вливается в W. bronchiales, откуда кровь через два коротких ствола вблизи ворот лёгкого вливается в V. azygos et V. hemiazygos. На периферии лёгкого Vv. bronchiales впадают в Vv. pulmonales. А области мелких бронхов существуют анастомозы между Rr. bronchiales и A. pulmonalis. Эта связь между малым кругом кровообращения и большим кругом контролируется мощными запирательными артериями. В норме они сокращены, и кровь в них не циркулирует. Если центральные области лёгкого не вентилируются, запирательные артерии открываются, и восстанавливается минимальный жизненно сохраняющий кровоток через систему большого круга кровообращения.
Респираторные бронхиолы, альвеолярные ходы, соединительнотканные перегородки, субплевральные ткани получают оксигенированную кровь через систему Vasa publica.
Лёгочная артерия, A. pulmonalis, сопровождает бронхиальное дерево до респираторных бронхиол. A. pulmonalis входит в лёгкое в области ворот, вентрально перекрещивает главный бронх. Её ветви располагаются в рыхлой перибронхиальной соединительной ткани и располагаются в центре сегментов лёгкого. Расположение артерии в рыхлой соединительной ткани позволяет ей смещаться придыхании. Тонкая стенка обеспечивает низкое давление крови. Ветви A. pulmonalis вплоть до 7-го порядка эластического типа. Стенки артерий эластического типа характеризуются мощным эластическим каркасом и развитым мышечным слоем. Мелкие ветви A. pulmonalis диаметром 2-3 мм построены по мышечному типу. Их тонкая стенка позволяет изменять диаметр артерии соответственно глубокому дыханию или увеличивать диаметр при увеличении минутного объёма сердца и повышении давления крови. Терминальные ветви лёгочной артерии располагаются между альвеолярными ходами и продолжаются в капилляры, окружающие альвеолы. Обычно терминальные ветви начинаются в конце респираторных бронхиол, но могут ответвляться под острым углом от основного ствола и раньше. Терминальные ветви A. pulmonalis известны в литературе как «бесчисленные артерии» («supernumerary arteries»). Между ветвями A. pulmonalis нет функционально значимых анастомозов. Поэтому блокада кровотока по артерии ведёт к инфаркту лёгкого. Кровоснабжение участка лёгкого зависит от его аэрации. Локальное снижение парциального давления кислорода приводит к местной ва- зоконстрикции и снижению кровотока через плохо аэрируемый участок.
Мышечные клетки в стенке внутрилёгочных сосудов появляются не ранее 20 недели гестации. К моменту рождения сосуды с мышечным компонентом стенки не достигают даже устья терминальных бронхиол. К терминальным бронхиолам такие сосуды подходят только на 4 месяце жизни. Мышечные элементы в стенках сосудов альвеолярных ходов появляются не ранее 3-4 годов жизни. Вокруг альвеол такие сосуды появляются только к 19 годам. Т.е. ребёнок оказывается защищён от спазма сосудов, непосредственно участвующих в газообмене.
Лимфатическая система лёгкого ориентирована на три компонента единой лёгочной соединительнотканной системы. Лимфатические сосуды начинаются в аксиальной и периферической соединительной ткани, но их нет в межальвеолярных перегородках. Внеклеточная жидкость межальвеолярных перегородок по септальной соединительной ткани переносится со скоростью 4-7 мл/ час в лимфатические сосуды аксиальной и периферической соединительной ткани. Лимфатические сосуды периферической соединительной ткани располагаются в висцеральной плевре и в соединительно-тканных перегородках, образуя густую нерегулярную трёхразмерную сеть. В области ворот лёгкого они сливаются с перибронхиальными и периартериальными лимфатическими сосудами. Перибронхиальные и периартериальные лимфатические сосуды начинаются как лимфатические капилляры в соединительной ткани проксимальных бронхиол и в дальнейшем проходят в центре сегментов, сетеобразно обвивая бронхи и артерии. Только в области ворот лёгкого в лимфатических сосудах появляется тонкий слой продольно расположенных гладкомышечных волокон. В области перехода от сегментарных к долевым бронхам появляются первые лимфатические узлы (Nn. lymphatidintrapulmonales). Отсюда лимфа через лимфатические узлы главных бронхов, бифуркации и трахеи попадает в Truncus bronchomediastinalis и Truncus bronchomediastinalis anterior. Ниже главных бронхов существует дополнительный канал оттока непосредственно в Ductus thoracicus. Часть поверхностно расположенных лимфатических сосудов базальных отделов лёгкого через Ligamentum pulmonale впадает непосредственно в Ductus thoracicus. Через лимфатические сосуды Ligamentum pulmonale лимфатическая система лёгких непосредственно связана с лимфатическими узлами брюшной полости. Этот путь с точки зрения распространения инфекции особенно актуален для детей.
Нервы лёгкого закладываются из эктодермы. Из нервной пластинки клетки мигрируют в стенку будущей трахеи и закладку лёгкого ещё до отделения трахеи от пищевода. На б неделе гестации уже можно определить симпатическую и парасимпатическую систему. Иннервация лёгких осуществляется через блуждающий нерв и симпатический ствол, ветви которых образуют на главных бронхах Plexus pulmonalis. Сплетение распространяется далее по бронхам и сосудам. Веточки к висцеральной плевре отходят непосредственно от ворот лёгкого. Эфферентные холинергические волокна обеспечивают мускулатуру бронхов, бронхиол, сосудов, а также слизистые железы и бокаловидные клетки. Эти же структуры иннервируются адренергическими эфферентными симпатическими волокнами. Афферентные волокна проходят в стволе блуждающего нерва и начинаются в рецепторах, расположенных в бронхиолах, бронхах и трахее и воспринимающих боль, растяжение и раздражение. Висцеральная плевра не сбдержитболевых рецепторов, и боль, возникающая, например, при плевритах, обусловлена раздражением рецепторов париетальной плевры. Стимуляция симпатических нервов ведёт к расширению дыхательных путей. Стимуляция парасимпатических - к сокращению мускулатуры бронхов и бронхиол, усиленной секреции слизистых желёз и бокаловидных клеток, расширению сосудов. Число нервов, обеспечивающих спазм бронхов, уменьшается после 3 лет жизни. Одновременно снижается бронхоспастический ответ на гистамин и метахолин.
Р-адренорецепторы и рецепторы для вазоактивного интестинального пептида появляются на эпителии лёгких, зачатках бронхов и в лёгочной артерии на 14 неделе внутриутробной жизни и их число существенно увеличивается на первом году жизни, а-1-адренорецепторы и мускариноподобные рецепторы появляются только на 23-24 неделях гестации.
Развитие лёгких приводит к тому, что они полностью заполняют правую и левую плевральные полости. Границы полостей определяются грудной клеткой, средостением и диафрагмой. С медиальной стороны лёгких появляется кардиальная ниша. Так как сердце расположено в основном слева, левое лёгкое на 10-207о меньше, чем правое. Разветвление бронхов и лёгочной артерии служат основанием для выделения долей, сегментов, долек и ацинусов. Левое лёгкое делится на 2, правое - на 3 доли. Доли отделяются друг от друга тонкими щелями (Fissurae horizontales et obliguae), простирающимися едва ли не до ворот легкого и образованными глубоким внедрением в паренхиму висцеральной плевры. Сегменты лёгкого имеют форму пирамид или шариков, верхушки которых направлены к воротам лёгкого. Сегментарные бронхи и артерии входят в верхушку сегмента, распространяются по центру. Вены расположены в соединительной ткани на поверхности сегмента. Соединительнотканный покров сегментов не сплошной и не образует абсолютной границы с другими сегментами. Дольки лёгкого разграничиваются тонкой соединительной тканью и образуют характерный полигональный рисунок костальной и диафрагмальной поверхности лёгкого. Считается, что дольки определяются бронхиолой первого порядка и начинаются в области перехода от бронхов к бронхиолам. Ацинус * область газообмена, определяемая терминальной бронхиолой или респираторной бронхиолой первого порядка. Дальнейшее деление указанных воздухопроводящих путей определяет объём ацинуса в пределах их 6-7 генераций, но может достигать 12. Так как собственно воздухопроводящие пути завершаются на уровне терминальных бронхиол, сумма ацинусов образует общий объём, где происходит газообмен.
В мире всё построено по высшему разуму: логично и целесообразно. И если мы этого не видим, то только потому, что не знаем. Анатомия и гистология лёгких полностью подчинены их функциональным задачам по оксигенированию крови и удалению углекислого газа. После рождения происходит смена типа оксигенации: трансплацентарный путь чрезвычайно быстро сменяется на диффузионный лёгочный. Как было сказано ранее, первые дыхательные движения зарегистрированы у 7-месячных плодов. Эти движения существенно определяют рост и развитие лёгкого. Внутриутробные дыхательные движения появляются только периодически и блокируются гипоксией. Постпартально организм попадает в условия свободного поступления большого объёма кислорода, но одновременно в 3 раза возрастают энергетические затраты. Происходит переключение периферических рецепторов на высокий уровень ра02 и переход нерегулярных дыхательных движений в постоянные. Пусковыми моментами постпартальных изменений регуляции дыхания является снижение температуры тела и повышение раС02. Начинается функционирование лёгких.
Функция лёгких определяется регуляцией дыхания. Задачи регуляции дыхания - поддержание стабильности парциального давления кислорода и углекислого газа в артериальной крови вне зависимости от потребления кислорода или образования углекислого газа. Регуляция осуществляется путём создания классического замкнутого круга. Существует центр регуляции, сенсорный (центральные и периферические хеморецепторы, механорецепторы) и эффектор- ный (дыхательная мускулатура) аппараты.
Центральный аппарат регуляции дыхания располагается в продолговатом мозге близ Nucleus ambiguus и Nucleus tractus solitaruis, продолжаясь в некоторые отделы моста мозга. Центр регуляции дыхания представляет собой сеть нейронов. Здесь находятся центральный генератор ритма и различные типы нейронов, активируемые или угнетаемые комплексом нейрорегуляторов и нейротрансмиттеров. Нейроны дыхательного центра иннервируют через двигательные нейроны спинного нерва дыхательную мускулатуру и, за счёт связи с другими центрами головного мозга, синхронизируют дыхание и тонус мышц языка, гортани, глотки, бронхов. Это позволяет снизить сопротивление потоку воздуха на вдохе.
Дыхательные рецепторы подразделяются на хеморецепторы и механорецепторы. Хеморецепторы подразделяются на центральные и периферические и реагируют на изменение химических компонентов крови и ликвора.
Центральные хеморецепторы находятся непосредственно в нейронной сети респираторного центра и на вентральной поверхности продолговатого мозга. Они являются самыми чувствительными и реагируют на повышение концентрации протонов водорода во внеклеточной жидкости и в ликворе. При гиперкапнии углекислый газ усиленно диффундирует через гематоэнцефалитический барьер, вытесняет ионы водорода, которые стимулируют центральные хеморецепторы. Углекислый газ диффундирует в 20 раз легче, чем кислород. Поэтому даже небольшие изменения раС02 вызывают существенные изменения частота и глубины дыхания.
Периферические хеморецепторы находятся в области разветвления общей сонной'артерии на внутреннюю и наружную (Glomus caroticum), в дуге аорты (GLomera aortica) и в правой подключичной артерии. Они иннервируются через N. glossophanngeus и N. laringeus, отвечая на гипоксию, в меньшей степени - на ацидоз и гиперкапнию. Периферические хеморецепторы очень хорошо кровоснабжаются (20 мл/г/мин). Артериовенозная разница напряжения кислорода в этих структурах минимальна. Поэтому они реагируют на изменение артериального р02. Порог раО^ за которым начинается активация рецепторов, составляет 110 мм рт.ст. То есть они отвечают на колебания ра02 при обычном дыхании, а скорость ответа позволяет им реагировать на колебания ра02 в пределах обычного дыхательного цикла.
Механорецепторы расположены в гладкой мускулатуре дыхательных путей. При растяжении стенок бронхов раздражение механорецепторов приводит к активации блуждающего нерва и блокаде вдоха, что предотвращает перерастя- жение лёгкого. Этот рефлекс получил название рефлекса Геринга-Броера. Он особенно активен у детей первых месяцев жизни, когда при глубоком вдохе возможно апноэ. У детей старшего возраста и взрослых рефлекс проявляется только при объеме вдоха, превышающем 1 литр. Но даже в этом случае апноэ не развивается, отмечается только уменьшение глубины и частоты дыхания.
К механорецепторам принадлежат также ирритационные рецепторы (рецепторы С и J). С-рецепторы находятся в эпителии трахеи и бронхов. Они активируются газами, дымом, пылью, холодным воздухом. При раздражении С-рецеп- торов развивается спазм бронхов, кашель, одышка и брадикардия. У детей грудного возраста, а у взрослых - во сне, раздражение С-рецепторов может вести не к кашлю, а к апноэ. J-рецепторы находятся в стенках капилляров и отвечают на увеличение объёма крови или интерстициальной жидкости. Их раздражение приводит к тахидиспное, а при перераздражении - к остановке дыхания. J-рецепторы приобретают особое клиническое значение при пневмонии, отёке лёгких или интерстициальных заболеваниях.
В носоглотке находятся механорецепторы, ответственные за чихание, кашель и бронхоконстрикцию. Клиническое значение имеют рецепторы гортани, реагирующие на химические и механические раздражители. Особенно активны эти рецепторы у новорождённых. Их активация молоком, кислым содержимым желудка, при интубации может привести к остановке дыхания, брадикардии и повышению давления в малом круге кровообращения.
Под термином «дыхательная мускулатура» объединяют межрёберные мышцы, мышцы брюшной стенки и диафрагму. Эффективное дыхание требует координации работы всех указанных мышечных групп. Ноу новорождённых (прежде всего) и во время сна в фазу быстрого движения глазных яблок (REM, фаза быстрого сна) эта координация нарушается. При этом развивается парадоксальное дыхание, когда инспираторное сокращение диафрагмы совпадает с экспираторным движением межрёберных мышц.
Интегрированная регуляция дыхания оказывается значительно сложнее, чем механически понятое взаимодействие дыхательного центра, рецепторов и дыхательной мускулатуры. Каждый из указанных компонентов подвергается влиянию многих факторов (возраст, степень зрелости ребёнка, бодрствование или сон, наличие заболеваний и т.д.)
Повышение раС02 ведёт к быстрому увеличению объёма вдоха (тидалевский объём). При недостаточной компенсации увеличивается и частота дыхания. Если раС02 повышается во сне, запускается реакция пробуждения. В фазу медленного сна (медленное движение глазных яблок - Non-REM) пробуждение происходит быстро, в фазу REM - медленнее. Относительное увеличение минутного объёма дыхания (тидалевский объём, тидалевское пространство) нарастает с возрастом. У взрослых повышение раС02 на 1 мм рт.ст. приводит к приросту минутного объема дыхания на 1-2 л/мин. Но очень быстро развивается адаптация, и у пациентов с хроническими заболеваниями лёгких с гиперкапнией дыхание регулируется гипоксией, а не гиперкапнией. Поэтому при даче им кислорода и, соответственно, быстром снятии гипоксии, возможно развитие выраженной гиповентиляции.
При физиологическом уровне раС02 снижение ра02 ниже 50-60 мм рт.ст. у детей и взрослых так же, как и гиперкапния, вызывает повышение минутного объёма дыхания. Но, в противоположность гиперкапнии, минутный объём дыхания повышается не так стремительно. Если одновременно существует и гиперкапния, минутный объём дыхания нарастает существенней и быстрее по времени. Однако у детей, живущих с рождения в условиях гипоксии (пороки сердца синего типа, хронические заболевания лёгких, условия высокогорья), эта реакция угнетена. Гипоксия, возникшая во сне, как и гиперкапния, вызывает пробуждение. Но у новорождённых и детей грудного возраста реакция пробуждения запаздывает. При длительно существующей гипоксии меняется «архитектоника» сна: фазы Non-REM урежаются, нарастает длительность и частота фаз REM. Сон становится поверхностным, прерывистым, полным кошмарных снов.
У плодов, недоношенных и новорождённых (особенно незрелых) реакция на гипоксию полностью отличается от таковой у более старших детей и взрослых. Снижение ра02 первоначально приводит, как и у более зрелых субъектов, к повышению минутного объёма дыхания. Но через минуту-другую включается центральный механизм угнетения дыхания вплоть до полного апноэ. Одновременно резко падает потребление кислорода тканями, голосовая щель спазми- руется, задерживая воздух в лёгких. И здесь мы видим механизм целесообразности. В условиях внутриутробного существования гипоксия не может быть исправлена регуляцией собственно дыхания. Дыхательные движения требуют больших энергетических затрат, которые не обеспечиваются сниженной трансплацентарной диффузией кислорода. Но после рождения, особенно у недоношенных, этот механизм ответа на гипоксию может привести к серьёзным нарушениям дыхания. У недоношенных детей порог гипоксии, за которым начинается неравномерное дыхание, на 10-20 мм рт.ст. выше, чем у доношенных и взрослых, и достигает 60-70 мм рт.ст.
У детей более старшего возраста и у взрослых в качестве реакции на гипоксию развивается физиологическое дыхание под постоянным повышенным давление на выдохе (ППДВ). Оно проявляется резким глубоким вдохом с медленным выдохом и последующей паузой. ППДВ развивается при снижении ра02 на 10 мм ниже нормы (исходной) независимо от pH крови или раС02. ППДВ - закономерная физиологическая реакция на асфиксию, которая проявляется первичной гипервентиляцией, затем первичным апноэ и ППДВ (30- 60 мин у новорождённых и 2-3 мин у взрослых). При сохраняющейся глубокой гипоксии развивается терминальное апноэ. ППДВ - действенный механизм самооживления и его нарушение у детей может быть одной из причин внезапной смерти.
На регуляции дыхания сказываются различные фазы сна. В фазу REM ра02 низкое, дыхание нерегулярное, дыхательные движения, особенно у недоношенных, парадоксальные, паузы в дыхании часты и длительны. Частота дыхательных движений выше, чем в фазу Non-REM, но объём вдоха ниже, поэтому минутный объём дыхания несущественно выше, чем в фазу Non-REM. В фазу REM у недоношенных каждые две минуты отмечаются вздохи, которые призваны возобновить вентиляцию в коллабированных участках лёгкого. В фазу Non-REM дыхание регулярное, апноэ и парадоксальное движение наблюдаются редко, ра02 выше, чем в фазу REM. В первые три месяца после рождения частота эпизодов Non-REM сна уменьшается и в дальнейшем остаётся стабильной на протяжении всей жизни, составляя 40-45% в общей длительности сна.
Периодическое дыхание (дыхание Чейн-Стокса) - чередование вдохов и коротких (4-10 сек) перерывов в дыхании. Недоношенные проводят 50% своего сна в состоянии периодического дыхания. Периодическое дыхание рассматривается как физиологическое у доношенных новорождённых и детей первых месяцев жизни. У взрослых периодическое дыхание наблюдается во сне при гипоксии, например, в условиях высокогорья. Патофизиология этого типа дыхания ещё не изучена. Существует мнение, что периодическое дыхание обусловлено сочетанием высокой чувствительности периферических хеморецепторов и низким содержанием кислорода в лёгких. Низкое содержание кислорода в легких ведёт к периодической активизации хеморецепторов.
Газообмен в лёгких осуществляется только за счёт разницы парциального давления газов по обе стороны диффузионного барьера. Становление газообмена полностью коррелирует с анатомическим и функциональным развитием лёгкого. При обструкции периферических бронхов аэрация соответствующей области лёгкого облегчается дополнительными каналами между альвеолами (коновские поры) и возникновением соустий между бронхиолами и ацинусами соседних групп за счёт открытия стенок альвеол (каналы Ламберта). Коновские поры появляются к 2 годам жизни, ламбертовские каналы - к 7. Отсутствие этих дополнительных каналов у новорождённых и детей грудного и младшего возраста повышает вероятность вентиляционно-перфузионных нарушений. При интерстициальных заболеваниях лёгких гипоксия никогда не возникает только за счёт нарушений диффузионного барьера* альвеолярно-капиллярного блока. Одновременно возникают внуфилёгочные шунты и нарушения региональной вентиляции.
Стабильность газообмена во многом обеспечивается сохранением некоторого объёма газа в лёгких после выдоха (до 30 мл/кг массы тела). Этот объём называется функциональной остаточной ёмкостью и является резервуаром кислорода, препятствующим десатурации крови в экспировавшем лёгком. У детей старшего возраста и взрослых объём воздуха, сохраняющегося в лёгких после выдоха, поддерживается равновесием между эластичностью лёгких и стабильностью грудной клетки. Указанный объём воздуха достигает 29-40% общего объёма лёгкого в положении лёжа и 50% - в положении стоя. У новорождённых оссификация костей не завершена, стабильность грудной клетки низкая. В то же время ретракционная сила лёгких при пересчёте на единицу объёма близка к таковой у взрослых. При расчёте теоретически ожидаемого в этих условиях остаточного объёма лёгких он должен составлять у новорождённых всего 10% от общей ёмкости лёгких. Такой объём при каждом выдохе создавал бы для новорождённого реальную опасность тяжёлой гипоксии. В действительности объём воздуха в лёгких после выдоха составляет у новорождённых 40% от общей ёмкости лёгких (30 мл/кг массы тела), хотя у недоношенных этот объём существенно ниже. Сохранение у новорождённых такого большого объёма воздуха, играющего роль буфера, достигается сокращением голосовых складок с торможением выдоха (включается механизм дыхания под постоянным положительным давлением) и ранней активацией дыхательной мускулатуры. Все это уравновешивает нестабильность грудной клетки. Но всякое угнетение центральной нервной системы (незрелость, тяжёлое заболевание, наркоз) ведёт к нарушению описанного компенсаторного механизма и повышению вероятности гипоксии.
Далеко не весь объём вдоха участвует в газообмене. Часть ингалированного воздуха попадает в анатомическое мёртвое пространство, т.е. в отделы лёгкого, не имеющие альвеолярного эпителия. Другая часть объёма вдоха попадает в неперфузируемые альвеолы (альвеолярное мёртвое пространство). Альвеолярное мёртвое пространство вместе с анатомическим мёртвым пространством образуют физиологическое мёртвое пространство. Наконец, только оставшаяся часть ингалированного воздуха достигает перфузируемых альвеол и участвует в газообмене. У здорового недоношенного (насколько недоношенный может быть здоровым) физиологическое мёртвое пространство достигает 41-43% объёма Ингалированного воздуха (тидалевского объёма). При остром респираторном дистресс-синдроме, рестриктивных заболеваниях лёгких, дистресс-синдроме новорождённых доля физиологического мёртвого пространства составляет 70% и более от тидалевского объёма.
Нормальный процесс вдоха-выдоха использует средние лёгочные объёмы, не достигая ни остаточного объёма, ни общей ёмкости лёгких. Остаточный объём (00) - это объём газа в лёгких в конце максимального выдоха. Общая ёмкость лёгких (ОЕЛ) - объём газа в лёгких в конце максимального вдоха. Жизненная ёмкость - разница между общей ёмкостью и остаточным объёмом.
Следующим этапом газообмена является перфузия. Перфузия альвеол осуществляется через артерии лёгких, распространяющиеся вдоль бронхиального дерева и продолжающиеся в преацинарные артерии. Существуют артерии, обеспечивающие дополнительную перфузию артерий и не распространяющиеся по бронхиальному дереву. Они предназначены для коллатерального кровообращения. Кроме того, 1% минутного объёма сердца поступает к лёгким через бронхиальные ветви аорты. Между бронхиальными артериями и лёгочными артериями существуют анастомозы, которые получили название множественных аор- то-лульмональных коллатералей. В норме кровоток через них минимален, клиническое значение они приобретают при врождённых пороках, затрудняя их коррекцию. У взрослых мышечные артерии простираются до субплевральных областей, у новорождённых они кончаются на уровне терминальных бронхиол и не достигают регионов газообмена. Физиологическое соответствие вентиляции и кровотока поддерживается анатомическими механизмами и локальным
сокращением лёгочных сосудов в плохо вентилируемых участках. За счёт открытия сосудов в прежде плохо вентилируемых участках кровоток в лёгком может возрасти в 4,5-5,5 раз. Но если сосуд начинает функционировать в плохо вентилируемом участке, т-е. физиологическая вазоконстрикция терпит крах, кровь, возвращающаяся из этих участков, не оксигенирована. Появляется внут- рилёгочный шунт с гипоксией. Нарушения соответствия вентиляции и перфузии имеет особое значение для развития гипоксемии у детей, в то время как у взрослых в качестве причин гипоксии преобладают нарушения диффузии.
У новорождённого парциальное напряжение кислорода в артериальной крови значительно ниже, чем у взрослого, т.е. альвеолярно-капиллярный градиент по кислороду повышен. Это объясняется право-левым шунтом, дис- и ателектазами не успевшего ещё адаптироваться лёгкого. Оксигенация достигает показателей взрослого только к 7 году жизни.
Таким образом, лёгкие - особый, сложно устроенный, глубоко интегрированный в структуры организма жизненно важный орган. Он настолько важен, что мы им не управляем. Мы контролируем работу кишечника, мочевого пузыря, мышц. Мы можем им сказать: «Не двигаться!». Но мы не можем задержать функцию лёгких. Единственно, что мы можем им сказать: «Двигаться. Двигаться! Дышать!!!».
Лёгкие приобретают привычные для нас форму, строение и адекватную функцию к 6-7 году жизни ребёнка. Но любое нарушение развития бронхов, бронхиол во внутриутробный период, в период родов или в период раннего детства существенно ограничивает функции лёгкого у ребёнка старшего возраста или взрослого. Нарушения развития могут быть обусловлены генетическим факторами, экзогенными (например, пассивное курение плода или новорождённого), вирусными инфекциями нижних отделов респираторного тракта, недоношенностью, искусственной вентиляцией и т.д.
В противоположность большинству других органов и систем, специфически функционирующих ещё в период внутриутробного развития, лёгкие как орган газообмена начинают функционировать только с рождения ребёнка. У плода будущее воздухоносное пространство лёгкого заполнено жидкостью. В момент первых вздохов оно буквально взрывным образом заполняется воздухом, и внутренняя поверхность лёгких вступает в свой постоянный контакте газовой средой. Точно так же резко фетальный тип кровообращения переводится на взрослый. Поэтому всё внутриутробное развитие лёгких нацелено на возможность перестройки типа дыхания и кровообращения. Для нормального газообмена после рождения ребёнка необходимо выполнить несколько условий:
создать широко разветвлённое дыхательное древо с мукоцилиарным механизмом самоочищения;
сформировать систему газообмена с большой поверхностью и эффективным барьером газ-кровь;
образовать поверхностную плёнку (сурфактант), препятствующую спадению лёгкого под действием поверхностного натяжения.
В лёгком можно принципиально выделить воздухопроводящие пути (трахея и бронхи) и область газообмена (паренхима лёгкого). В начале своего развития оба эти отдела неразличимы, в завершении они дифференцируются в морфологически и функционально специфические структуры. Из эмбрионального зачатка трахеи за счёт дихотомического деления возникает 16 поколений (генераций, уровней, порядков по разной терминологии) воздухопроводящих путей, которые завершаются терминальными бронхиолами. К терминальным бронхиолам примыкают в среднем 3 генерации респираторных бронхиол, затем - ductus alveolares (3 генерации) и, наконец, sacculus aLveolares (3 генерации).
В паренхиме дифференцируются эпителий дыхательных путей, соединительная ткань и капиллярная сеть будущих межальвеолярных перегородок. Капилляры теснейшим образом соприкасаются с плоским альвеолярным эпителием I типа, что минимизирует диффузионный барьер воздух-кровь. Его толщина составляет 0,05-0,25 мкм. Для функции газообмена чрезвычайно важна своевременная дифференцировка альвеолярного эпителия II типа, вырабатывающего сурфактант. Без сурфактанта паренхима лёгкого необратимо коллабирует на границе раздела газ-жидкость. В итоге у взрослого внутренняя поверхность лёгкого (совокупная поверхность альвеол) достигает 140 м2 (чуть меньше большого теннисного корта) при общем объёме лёгкого 4,5 л и числе альвеол - более 300 млн. Таким образом, внутренняя поверхность лёгких почти в 50 раз больше поверхности тела. Альвеолярная поверхность капилляров составляет 120 м2, ежедневный кровоток - 7000-8000 л, доля воздухоносного пространства в лёгком - 87%. На капилляры приходится 40% объема паренхимы. Эта потрясающая по своей сложности структура формируется с эмбрионального периода и до 2-3 летнего возраста качественно, проходя несколько стадий (табл. 1), чтобы затем начать количественный (линейный) рост.
Временные границы отдельных стадий развития лёгкого относительны. В одном и том же лёгком в разных его участках в зависимости от их положения (краниально-каудально или центрально-периферически) могут одновременно протекать разные стадии развития (табл. 2).
Эмбриональная стадия - этап неспецифического развития лёгкого. Лёгкое формируется из энтодермального листка. Лёгкое закладывается и на первых этапах развивается как железистый орган. На 26 день после оплодотворения на передней кишке появляется вентральный дивертикул (лёгочная почка), который растёт в каудальном направлении в окружающую мезенхиму мезодермы. Между зачатком лёгкого и будущим пищеводом появляется желобок, который углубляется и формируется перегородка, отсутствующая в области будущего гипофаринкса.
Тут же после образования лёгочной почки она начинает делиться, так что к 32 неделе беременности определяются 5 маленьких мешочков, будущих глав-
ных и долевых бронхов и долей лёгкого. Начиная с 7 недели гестации, появляются субсегментарные веточки бронхиального дерева. В мезенхиме появляется и сосудистое сплетение.
Клиническое значение эмбриональной стадии заключается в возможном сохранении сообщения между трахеей и пищеводом в виде фистул. Частота трахеоэзофагеальных свищей составляет 1:3000-1:3500 живорождённых. Существует 5 вариантов атрезии пищевода и/или трахеоэзофагеальной фистулы. В 90% - это слепое завершение проксимальной части пищевода и трахеоэзофагеальная фистула с его нижним сегментом. Случаев агенезии лёгкого как следствия влияния тератогенных факторов мало, т.к. при раннем влиянии тератогенных факторов чаще происходит гибель эмбриона.
Псевдогландулярная стадия - промежуточный этап между эмбриональным и фетальным периодами. Указанная стадия известна как преацинарное деление воздухоносных путей и сосудов (Р. Jeffery е.а., 1994). Именно на этой стадии начинается собственно специфическое развитие лёгкого. В начале этой стадии лёгкое микроскопически выглядит как разветвлённая железа и мало напоминает будущее лёгкое, хотя морфологическая картина других органов в это время уже достаточно специфична. Железистые ходы построены из однорядного цилиндрического эпителия, высота которого убывает к периферии. Эли- телиапьные клетки, богатые гликогеном, формируют вначале небольшие, но со временем увеличивающиеся ходы. В конце псевдогландулярной стадии за счёт дихотомического деления возникают 16 новых генераций воздухопроводящих путей вплоть до преацинарных пространств. Общее число генераций бронхиального дерева достигает 20. В конце 10 недели в стенках бронхов появляются хрящи и гладкая мускулатура. Дифференцировка дыхательных путей протекает центрофугально. В центральных отделах лёгкого воздухопроводящие пути уже оказываются выстланы реснитчатым эпителием и бокаловидными клетками, а в периферических отделах сохраняется мало дифференцированный кубический эпителий. Неравномерность дифференциации имеет большое значение для роста лёгкого. Периферические недифференцированные ходы служат своеобразным «бором» при продолжающемся росте структур лёгкого и их внедрения в окружающую соединительную ткань.
Клиническое значение псевдогландулярной стадии достаточно велико. Нарушения развития лёгкого на этом этапе касаются, прежде всего, бронхов. Уменьшение числа бронхов приводит к гипоплазии лёгкого. Кроме того, на этой стадии происходит образование диафрагмы и полное разделение плевро-перитонеального канала. При неблагоприятных условиях формируются различной степени выраженности диафрагмальные грыжи, которые косвенно, за счёт сдавления лёгкого, приводят к его гипоплазии. Частота диафрагмальных грыж составляет 1:2000-1:3000 живорождённых.
Каналикулярная стадия характеризуется формированием контакта между эпителиальными канальцами и капиллярами. Мезенхима буквально пронизывается (канализируется) быстро растущими и вновь образующимися капиллярами. Расширяющиеся и быстро растущие тубулярные структуры прежней псевдогландулярной стадии внедряются в окружающую паренхиму и вступают в тесный контакт с капиллярами. Одновременно с этим начинается дифференцировка альвеолярного эпителия. Часть кубического эпителия незрелых тубулярных структур начинает уплощаться и образовывать альвеолярные эпителиальные клетки I типа. Эти клетки - предшественники тончайшего барьера газ-кровь. Другие клетки, сохраняя более или менее кубическую форму, начинают накапливать ламеллярные включения, являющиеся ничем иным как предшественниками сурфактанта. На стадии канали- кулярного развития впервые в околоплодных водах обнаруживается сурфактант. Только благодаря наличию плёнки сурфактанта на границе раздела будущей воздухоносной полости и поверхности альвеолы возможно расправление лёгкого при первом вздохе и невозможность коллабирования при выдохе. Сурфактанту человеческого плода начинает образовываться на 155- 160 день гестации, т.е. в начале 2-ой половины внутриутробного развития. V остальных млекопитающих сурфактант появляется после завершения 3/4 срока гестации.
Способные к делению клетки II типа служат предшественниками пневмоци- тов типа I и II. Клетки I типа, будучи чрезвычайно тонкими и сложно устроенными, к делению не способны. Начиная с 20 недели, иммуногистохимическими методами обнаруживаются и первые нейроэндокринные клетки. Наряду с дифференцированными клетками сохраняется недифференцированный кубический эпителий. Важнейшими итогами каналикулярной стадии является формирование контакта эпителия и капилляров и появление первых очагов функционально способной паренхимы.
Клиническое значение каналикулярной стадии - появление диффузионных возможностей и будущего формирования воздухоносного органа. По завершению этой стадии недоношенный может совершать газообмен и получает свой первый шанс на внеутробное существование. Нарушения, возникающие на этой стадии, затрагивают в основном структуры газообмена и заключаются в структурных изменениях паренхимы лёгкого. Уменьшение числа и объёма пространств газообмена выражается в гипоплазии легкого.
Саккулярная стадия характеризуется интенсивным развитием паренхимы лёгкого. За счёт дихотомического деления возникают последние генерации воздухоносных путей. После 3 поколений респираторных бронхиол появляются 3 генерации альвеолярных ходов. Их стенки являются первичными перегородками. В первичных перегородках всё ещё определяется большое количество соединительной ткани, хотя она быстро замещается сетью эластических волокон и капиллярной сетью. Паренхимы становится всё меньше, и контакт между капиллярами и эпителием становится теснее. Интенсивно продолжается дальнейшая дифференцировка эпителия. Только на периферии сохраняются небольшие участки кубического эпителия. В саккулярных образованиях начинается образование альвеол.
Клиническое значение саккулярной стадии. Большинство недоношенных с респираторным дистресс синдромом рождаются в период саккулярной стадии, когда образование альвеол только начинается. Тем не менее, лёгкое находится на такой степени зрелости, что недоношенный уже способен обеспечить себя кислородом. Нарушение развития лёгкого на последних неделях беременности приводит к незавершённости его созревания и уменьшению числа альвеол.
Функции лёгких у плода
Главная функция лёгких в период внутриматочного развития - образование жидкости, которая через трахею, рот и нос изливается в амниотическую полость или частично проглатывается. В экспериментах на овцах показано, что в лёгких образуется 15 мл жидкости на кг массы плода в час. Таким образом, лёгкие - важнейший источник амниотической жидкости (S. Tschanz u.a., 1999). В условиях усиленного дренажа жидкости развивается гипоплазия лёгкого с задержкой развития органа, снижением его массы и уменьшением числа генераций дыхательного аппарата. Такие же изменения наблюдаются у человека при маловодий. При атрезии трахеи, когда жидкость не покидает лёгкое, оно значительно расширяется, но созревание собственно лёгкого нарушается мало. Страдает синтез протеинов А, В и С сурфактанта. На развитии лёгкого сказывается секреция жидкости эпителием лёгкого, положительное давление за счёт голосовой щели и верхних дыхательных путей, адекватный объём внутригруд- ной и амниотической жидкости, дыхательные движения плода. Первые дыхательные движения начинаются в конце псевдогландулярной стадии развития. Денервация лёгкого с отсутствием нормальных дыхательных движений приводят к уменьшению его размеров на 60-70%.
Постнатальное развитие лёгкого начинается с взрывообразного изменения условий его существования. Жидкость в воздухоносных путях очень быстро замещается воздухом. Часть её регургитируется, основной объём резорби- руется в кровь и лимфу. Одновременно меняется соотношение потоков крови в большом и малом круге кровообращения. За счёт закрытия артериального протока и овального окна большая часть минутного объёма сердца поступает в малый круг кровообращения. Прирост объёма крови, протекающей через лёгкие, обеспечивается резким падением тонуса артерий.
В момент рождения лёгкое находится в самом начале стадии образования альвеол. Поэтому рождения ребёнка не означает смены одной стадии развития другой.
Стадия образования альвеол (с 36 недели гестации до 1,5-летнего возраста) начинается ещё внутриутробно, однако основная масса альвеол образуется после рождения. Из первичных перегородок, представляющих собой паренхиму, начинают вытягиваться вначале мелкие, а затем всё более заметные гребешки, называемые вторичными перегородками. И первичные, и вторичные перегородки имеют по два слоя капилляров, прилежащих к поверхности раздела газ-ткань. Таким образом, каждый из диффузионных барьеров имеет собственную капиллярную сеть. Между слоями капилляров располагается нежная соединительная ткань, представленная эластическими волокнами. Именно за счёт тяги этих волокон и появляются вторичные перегородки. В результате резко увеличивается внутренняя поверхность лёгких. Но вторичные перегородки появляются только в участках с двойным слоем капилляров. Вторичные перегородки формируются как складки одной из поверхностей первичной перегородки с принадлежащей ей капиллярной сетью. Соединительная ткань, расположенная между капиллярными сетями, постепенно истончается, так что капилляры в итоге очень тесно прилежат друг к другу. Последнее является условием для благополучного прохождения стадии созревания микрососудов, которая начинается вскоре после рождения ребёнка тут же после образования альвеол. К моменту рождения, по разным данным, имеется от 1х106 до 50х10б альвеол. У взрослых, в зависимости от размеров тела, их от 200x10* до 600x10*. Альвеолы формируются до 1,5-летнего возраста. Но подавляющее число альвеол появляется в первые б месяцев жизни ребёнка.
Стадия созревания микрососудов длится с рождения до 3-го года жизни и является последней стадией качественного роста лёгкого. Она тесно связана со стадией образования альвеол. В течение длительного времени эти две стадии в различных участках лёгкого протекают параллельно. Стадия созревания микрососудов приводит к образованию зрелых вторичных перегородок и завершает стадию образования альвеол. Первичные и вторичные перегородки, образующие альвеолы у плода, новорождённого и ребёнка грудного возраста, по своим морфологическим характеристикам не соответствуют зрелым межальвеолярным перегородкам взрослого. Незрелые межальвеолярные перегородки включают в себя большое количество соединительной ткани и двойную сеть капилляров. Важнейший этап трансформации перегородок - уменьшение количества соединительной ткани и истончение этих перегородок. По результатам морфометрических исследований показано, что после рождения, несмотря на интенсивный рост лёгкого, количество соединительной ткани в нём существенно уменьшается. Уменьшение объёма тканей происходит за счёт двух процессов: апоптоза и дегидратации межклеточного пространства. Близко расположенные капилляры двух параллельных сетей начинают сливаться. Резкое уменьшение толщины перегородок, сближение капиллярных слоёв и слияние капилляров приводит к резкому увеличению числа микрососудов в единице объёма ткани. Это является важнейшим условием массивнейшего кровотока при его тесном контакте с воздухом. По мере дальнейшей редукции соединительной ткани в межальвеолярных перегородках появляются т.н. коновские поры. Диаметр коновских пор составляет 2-13 мкм. В зрелой межальвеолярной перегородке взрослого насчитывается 5-7 пор. Фенестрация пор приводит к контакту альвеолярного эпителия типов I и II. Коновские поры служат для дополнительной циркуляции газов в патологических условиях не только по поверхности капиллярной сети, но и сквозь неё, из одной альвеолы в другую. В настоящее время доказано, что коновская пора в норме закрыта сурфактантовой плёнкой. Коновские поры - ворота для макрофагов, которые мигрируют из одной альвеолы в другую.
С завершением созревания микрососудов завершается и образование альвеол, хотя и у взрослого в небольшом количестве обнаруживают толстые перегородки с двойным слоем капилляров. В конце стадии созревания микрососудов морфология лёгкого ребёнка соответствует морфологии лёгкого взрослого человека. Межальвеолярные перегородки оказываются тонкими, с очень нежным каркасом соединительной ткани и густой сетью капиллярных петель, распространяющихся от одной поверхности перегородки к дру-
Клиническое значение постнатального развития лёгкого. В связи с тем, что образование альвеол тесно связано с созреванием микрососудов, нарушения развития лёгкого в этот период затрагивают обе эти стадии. Нарушение формирование альвеол происходит либо за счёт непосредственного патологического влияния, либо косвенно, за счёт нарушения созревания микрососудов. Например, назначение глюкокортикоидов способствует созреванию перегородок, но при этом не происходит образование новых перегородок и, соответственно, уменьшается число вновь образованных альвеол.
Рост лёгкого. На первом году жизни созревание и рост лёгкого протекают параллельно. Только после завершения созревания микрососудов начинается период линейного («простого») роста лёгкого. Выделяют ранний и поздний периоды роста лёгкого.
Ранний период длится от рождения до 3 лет. В этот период большинство параметров лёгкого по отношению к объёму лёгкого изменяется непропорционально. Прежде всего увеличивается объём пространства, задействованного в транспорте кислорода. Таю у ребёнка 1 месяца доля воздухоносного пространства в паренхиме составляет 75%, в 5 лет - 86%. Эти изменения происходят за счёт углубления воздухоносных полостей, увеличения высоты межальвеолярных перегородок без существенной перестройки паренхимы. Доля капиллярной крови в межальвеолярной перегородке по отношению к общему объёму перегородки у новорождённого составляет 12%, у 5-летнего - 37%, у взрослого - 42%. Эти изменения обусловлены созреванием и ростом капилляров. Указанные механизмы оригинальны. Из одной стенки капилляра к другой прорастает столбик соединительной ткани. Продлеваясь по длине капилляра, он разделяет поток крови в капилляре на 2 рукава. Такой тип роста капилляров был впервые описан в лёгком, но позднее обнаружен и в других органах, где требуется быстрое увеличение числа капилляров и плотности капиллярной сети. Увеличение доли воздухоносного пространства и объёма крови в паренхиме лёгкого идёт за счёт уменьшения объёма тканей. За первый год жизни доля ткани в межальвеолярных перегородках уменьшается с 23 до 14%. Уменьшение доли ткани происходит почти исключительно за счёт соединительной ткани: её доля снижается с 57 до 37%. Число пневмоцитов типов I и II и клеток эндотелия меняется несущественно.
Поздний период роста лёгкого начинается с 3 лет и длится до завершения роста костных структур грудной клетки. Лёгкое растёт в целом пропорционально общим размерам тела. Исключение составляет только объём крови в капиллярах, который и в позднюю фазу роста увеличивается с опережающей скоростью (с экспонентой 1,15) и определяет диффузионную способность.
Анатомия респираторной системы полностью подчинена физиологическим целям: газообмену. За те секунды, которые кровь проводит в капиллярной сети альвеол, она должна успеть насытиться необходимым кислородом и отдать углекислый газ, образовавшийся в организме в процессе метаболизма. Достаточно сказать, что при тяжёлой работе человек потребляет до 5 литров кислорода в минуту. Проблема газообмена может быть решена только одним путём: сочетать максимально возможную площадь газообмена в заданном объёме органа. Это достигается с помощью сильно разветвлённого бронхиального дерева, которое начинается с трахеи и после 23 ветвлений завершается в регионе собственно газообмена: в альвеолах. Макроскопическое деление лёгких на доли, сегменты и дольки соответствует генерациям бронхиального дерева: долевым, сегментарным бронхам и бронхиолам. Область газообмена начинается с первых альвеол в респираторных бронхиолах.
Трахея и два главных бронха связывают гортань с лёгкими. Передняя и боковые стенки трахеи и бронхов образованы подковообразными хрящами, соединёнными фиброэластической мембраной. Густая сеть коллагеновых и эластических волокон, образующих фиброэластическую мембрану, вертикально натянутую между хрящевыми полукольцами, обуславливает возможность изменения длины трахеи и бронхов. Благодаря мембране трахея и бронхи способные увеличиваться в длину на 50% своего первоначального размера. Задняя стенка построена из соединительной ткани и мышечной пластинки. Последняя образована гладкой мышцей М. trachealis, волокна которой лежат в поперечном направлении. Подковообразные хрящи трахеи и бронхов стремятся развернуться, а трахеальная мышца играет роль тетивы, удерживающей их и регулирующей диаметр трахеи и главных бронхов. При спокойном дыхании мышца напряжена. При форсированном дыхании тонус мышцы снижается, и диаметр трахеи увеличивается. Слизистая оболочка трахеи и бронхов плотно прилежит к их передней и боковым стенкам. На задней стенке она подвижна и при сокращении М. trachealis собирается в вертикальные складки. Диаметр проводящих дыхательных путей и их длина при прочих равных условиях (вязкость газа, природа воздушного потока) определяют сопротивление потоку воздуха. Во время спокойного дыхания воздушный поток, особенно в малых дыхательных путях, ламинарный. В таких случаях сопротивление пропорционально 4-х кратному радиусу просвета бронха. При высокой скорости потока он становится турбулентным, и сопротивление нарастает. Как видно из соотношения диаметра бронха и сопротивления потоку воздуха, даже небольшое изменение просвета бронха существенно повышает сопротивление дыханию. Этот феномен особенно выражен у новорождённых.
Респираторный эпителий трахеи состоит из многослойного призматического эпителия и представлен в основном базальными клетками, мерцательным эпителием и бокаловидными клетками. Наряду с этим имеется большое число эндокринных и нейроэндокринных клеток. Базальные клетки лежат на базальной мембране, но не достигают поверхности эпителиального слоя. В терминальных бронхиолах между реснитчатыми клетками вкраплены прозрачные клетки.
Они характеризуются высокой метаболической и секреторной активностью, играют роль стволовых клеток. С16 недели гестации обнаруживаются внутриэпителиальные лимфоциты. У взрослых в эпителии находятся и мастоциты, но у плодов их нет.
Все клетки лёгочного эпителия развиваются путём дифференциации и созревания примитивных энтодермальных клеток. Процесс протекает центрифу- гально: от крупных дыхательных путей к периферическим. Прозрачные клетки (безреснитчатые бронхиолярные клетки) развиваются во второй половине внутриутробного периода из примитивных безреснитчатых гликогенсодержащих клеток терминальных дыхательных путей. Созревание заключается в постепенной потере гранул гликогена, накоплении рибосом и появлении электронноплотных секреторных гранул. В гранулах содержится большое количество антипротеаз.
В проксимальных и дистальных воздухоносных путях по мере созревания лёгкого от фетального периода к постнатальному толщина клеточного уменьшается и нарастает относительный размер просвета бронха.
Дыхательные пути выстланы изнутри слоем секрета, образованного бокаловидными клетками, подслизистыми железами. Он - важнейший и защитный барьер и защитный механизм эпителия. Барьер - как слой и механизм - как способ очистки. Секрет не однородный, он устроен сложно. Секрет разделяется на два слоя. Пристеночно расположен жидкий водный слой (золь). Собственно секрет - верхний слой (гель), более плотный, вязкий. Золь состоит из секрета желёз, капиллярного транссудата, межтканевой жидкости и представляет собой раствор различных химических соединений. Эта жидкость имеет вязкость, сходную с вязкостью плазмы. Толщина слоя золя (водной гипофазы секрета) стабильна, т.к. она обеспечивает свободные колебательные движения ресничек. В составе геля, собственно секрета, основное значение принадлежит гликопротеинам, которые секретируются бокаловидными клетками. Кроме того, в состав геля входяттрансферрин, лизоцим, альбумин и другие соединения, выделяемые бокаловидными клетками и поступающие в результате транссудации из капилляров (иммуноглобулин А, сурфактант, комплекс липидов), играющие важную роль в адгезии секрета и сказывающиеся на структуре слизи. Все элементы связаны дисульфидными, ионными и другими связями. Гелевый секреторный слой находится на ковре из ресничек, погружённых в жидкую гипофазу (золь). Реснички мерцательного эпителия внедряются в водную гипофазу и своими колебательными движениями переносят расположенный на гипофазе слизистый слой в сторону глотки. Деление на водную гипофазу (золь) и слизистый слой (гель) имеет большое физиологическое значение. Незначительная вязкость гипофазы облегчает биение ресничек эпителия, а высокая вязкость слизистого слоя обуславливает захват и транспорт инородных частиц. Т.е. для мукоцилиарного клиренса необходимы хорошая работа ресничек и соответствующие реологические параметры секрета, прежде всего - вязкость и эластичность. Изменение двух последних величин тут же сказывается на мукоцилиарном транспорте: вязкий секрет невозможно продвинуть, жидкий - «работа вхолостую».
Вязкость и эластичность секрета зависят от количества воды и входящих в его состав гликопротеинов - муцинов. Муцины секрета принадлежат к двум различным подтипам: кислые муцины (сиало- и сульфомуцины) и нейтральные (фукомуцины). Сиаломуцины гидрофильны и составляют 55% всех гликопротеинов. Фукомуцины гидрофобны и составляют 40% всех гликопротеинов. Оставшиеся 5% приходятся на нейтральные гликопротеины - сульфомуцины. При различных патологических состояниях с нарушением секреции соотношение этих гликопротеинов меняется, но определяющим является концентрация сиало- и фукомуцинов. Снижение уровня сиаломуцинов сопровождается уменьшением водного компонента секрета, что характерно для большинства заболеваний органов дыхания, протекающих с нарушением секреции. Вместе со снижением уровня сиаломуцинов увеличивается количество фукомуцинов, отталкивающих воду. Всё это приводит к тому, что секрет становится вязким и густым. При общем снижении количества муцинов вязкость уменьшается. Патофизиологические, реологические и клинические проявления большинства заболеваний дыхательных путей и ЛОР-органов свидетельствуют о важности секреторных нарушений как патогенетического звена. Так, воспаление сопровождается гипертрофией, гиперплазией, гиперфункцией бокаловидных железистых клеток с усилением секреции слизи, уменьшением сиаломуцинов, значительным увеличением количества фукомуцинов, что приводит к повышению вязкости слизи. Последнее цедёт к застою, что, соответственно, способствует размножению бактерий. В этих условиях реснитчатый эпителий работает с усиленной нагрузкой, но не в состоянии обеспечить должный транспорт слизи. Длительная перегрузка приводит к истощению мукоцилиарного аппарата, дистрофии и атрофии эпителия. Хроническое воспаление, заболевания с интерстициальным компонентом, аутоиммунными реакциями сопровождаются уменьшением секреции слизи, уменьшением толщины водной гипофазы. При различных патологических состояниях вязкость и эластичность секрета меняются различным образом, и различные комбинации реологических параметров могут давать много разновидностей секрета, что требует осмысленного подбора муколитиков.
В собственной пластинке (Lamina propria) и частично между хрящевыми полукольцами располагаются многочисленные слизистые железы, где они могут простираться вплоть до адвентиции. У взрослых слизистые железы занимают до 12% площади стенки бронха, у детей - 17%. Т.е. гипертрофия слизистых желёз способна вызвать у детей значительно больше изменений, чем у взрослых (W. Field, 1968; К. Matsuba е.а., 1972). Железы закладываются в трахее на 10 неделе гестации. По мере развития лёгкого они концентрируются в области бифуркации бронхов и по переднебоковым стенкам.
Строение респираторного тракта представлено в таблице 3.
Бронхи начинаются с участка бифуркации трахеи. Строение стенки главных бронхов соответствует строению стенки трахеи. Начиная с долевых бронхов, подковообразные хрящи начинают замещаться хрящевыми пластинками. Одновременно М. trachealis, расположенная в трахее по задней поверхности распространяется на всю окружность бронха, формируя Tunica musculans. Она ох-
ватывает весь бронх и обильно пронизана эластическими волокнами. Хрящевые элементы стенки бронха уменьшаются к периферии, одновременно нарастает число мышечных элементов. В мелких бронхах мышца становится основным составляющим элементом его стенки. Так, в бронхах гладкие мышцы занимают 3% стенки, в бронхиолах -10-20%. Мышечные пучки располагаются спирально, перекрещивая друг друга, пронизанные множественными эластическими волокнами.
Гладкие мышцы бронхов появляются на 6-8 неделе гестации. Спонтанные сокращения гладких мышц бронхов появляются в первом триместре беременности. К моменту рождения мышцы бронхов зрелые, иннервированы, способны к сокращению. У плода и ребёнка мышечная масса бронха относительно его размеров больше, чем у взрослого. У недоношенных мышечная масса бронхов относительно их размеров больше, чем у доношенных. У детей раннего возраста мышечная масса бронхов значительно увеличивается после искусственной вентиляции или постинфекционного бронхиолита (A. Hislop е.а., 1987; 1989).
Собственная пластинка слизистой содержит в L. elastica mucosae многочисленные эластические волокна, ориентированные по длине бронха. Бронхи, как и трахея, выстланы изнутри многорядным высокопризматическим мерцательным эпителием с включением базальных и бокаловидных клеток. В местах максимальных нагрузок в области бифуркации крупных бронхов, особенно в области бифуркации трахеи, мерцательного эпителия нет. Он заменяется многорядным плоским неороговевающим эпителием.
Переход от бронхов к бронхиолам трудноуловим и определяется исчезновением хрящевых пластинок и изменением эпителия. Давление воздуха в бронхиолах очень умеренное. Кроме того, их просвет по всем трём пространственным осям сохраняется за счёт натяжения соединительной ткани лёгкого. Поэтому стенка бронхиол, кроме слизистой оболочки, образована тонким слоем мышц и нежной адвентицией. Мышечные слои располагаются циркулярно и спиралеобразно и усилены эластическими волокнами. Эластические волокна связаны с мощными продольно расположенными волокнами Lamina elastica mucosa. Последние простираются до входа в альвеолы и образуют т.н. аксиальную соединительную ткань. Эластические волокна притягивают стенки бронхиол к соединительнотканным междольковым перегородкам и к плевре, т.е. к периферической соединительной ткани (покровная соединительная ткань). Эластическая тяга лёгочной ткани обуславливает открытие бронхиол в случае их коллапса. В противоположность этому сокращение мускулатуры в стенках и повышение давления паренхимы лёгких ведёт к закрытию просвета бронхиол. Причём особое значение имеет повышение паренхиматозного давления. Это случается при ранении лёгкого, накоплении жидкости в плевральной полости.
Клинически значимое изменение диаметра воздухоносных путей в зависимости от дыхания (уменьшение диаметра на выдохе и увеличение диаметра за счет тяги соединительной ткани расправляющихся лёгких) наблюдается только в бронхиолах и мелких бронхах. Диаметр средних и крупных бронхов при вдохе и выдохе меняется незначительно.
Бронхиолы выстланы однорядным кубическим мерцательным эпителием, между клетками которого находятся прозрачные клетки апокриновой секреции. Последние заменяют бокаловидные клетки, расположенные в более крупных воздухопроводящих путях.
Терминальными бронхиолами заканчиваются собственно воздухопроводящие пути, и начинается область газообмена. Появление первых альвеол - признак респираторных бронхиол. Альвеолы в виде полушарий прикреплены к стенкам бронхиол. Если альвеолы оказываются сгруппированными, их отделяет друг от друга только общая межальвеолярная (интеральвеолярная) перегородка. Межальвеолярные перегородки, густо пронизанные капиллярами, и внутриаль- веолярное пространство обозначаются как паренхима лёгких. Здесь и происходит газообмен.
В области газообмена (в респираторной зоне) выделяют три региона.
Bronchioli respiratorii, респираторные бронхиолы, представляют собой переходные структуры к собственно области газообмена. Они начинаются4 дистальнее терминальных бронхиол, ветвятся 1-3 раза, образуя респираторные бронхиолы 1-3 порядков (генерации). В их стенках появляются вначале отдельно расположенные альвеолы, ниже - группы альвеол, пронизывающих гладкую мускулатуру и слизистую оболочку стенки бронхиолы.
Ductus atveolares насчитывают 2-3 генерации и практически полностью усеяны альвеолами. Стенка альвеолярных ходов представляет собой, по сути дела, входы в альвеолы (альвеолярные кольца). Альвеолярное кольцо усилено мышечными и соединительнотканными волокнами.
Sacculi alveolares завершают дыхательные пути. Это мешочкообразные воздухоносные пространства, стенки которых образованы многочисленными альвеолами.
Отдельная терминальная бронхиола, завершающаяся респираторной бронхиолой, альвеолярные ходы (2-8) и альвеолярный мешочек образуют респираторный ацинус, диаметром около 1 см. Ацинус - базовая респираторная единица лёгкого.
Внутренняя поверхность респираторных бронхиол выстлана однорядным кубическим мерцательным эпителием с включением секреторных клеток. Клетки мерцательного эпителия прослеживаются вплоть до входа в альвеолы. В альвеолярных ходах и альвеолярных мешочках находятся только клетки альвеолярного эпителия. В области перехода от воздухоносных путей к собственно респираторному региону находится очень небольшое количество клеток щёточного эпителия (тип-Ш-пневмоцитов). На апикальной поверхности пневмо- цитов III типа циркуяярно сгруппированы микроворсинки, почему клетки и получили название щёточного эпителия. Щёточный эпителий теснейшим образом связан с нервными волокнами и рассматривается как механо- и/или хемо- рецепторный аппарат.
Альвеолы разграничиваются межальвеолярными перегородками, но этот барьер не является абсолютным. Зрелая альвеолярная перегородка содержит центральную капиллярную сеть и, в качестве несущего элемента, соединительную ткань. Каждый капилляр контактирует с двумя поверхностями межальвеолярной перегородки. На одной стороне диффузионный барьер построен из эпителия, базальной мембраны и эндотелия. На другой стороне диффузионный барьер оказывается чуть сложнее: к перечисленным структурам добавляется соединительная ткань. Поверхность альвеолярной перегородки выстлана тончайшей эпителиальной клеткой: эпителиальная клетка типа I. Между ними рассеяны альвеолярные макрофаги, осуществляющие иммунную защиту и клиренс мельчайших инородных тел.
Пневмоциттипа I происходят как из недифференцированных клеток, так и из пневмоцитов типа II. Пневмоциттипа I является высокоспециализированной клеткой, формирующей тончайшую поверхностную мембрану диффузионного барьера. Ядро клетки располагается между петель капиллярной сети и окружено тончайшим слоем цитоплазмы. Толщина клетки вне области расположения ядра составляет всего 0,05-0,2 мкм, длина достигает 50 мкм. В результате одна клетка покрывает 5000 мкм2 площади альвеолы. Эпителиальные клетки типа I (пневмоциты типа I), составляя всего 30% от общего числа альвеолярных клеток, занимают 97% площади альвеолы.
В диффузионном барьереапителий и эндотелий капилляров разделены только слившимися базальными мембранами. Общая толщина диффузионной мембраны составляет 0,2-0,4 мкм. Соединительная ткань расположена на противоположной стороне от капилляров, тесно связана с ними и образует опорный каркас межальвеолярной перегородки. Здесь путь газовой диффузии чуть длиннее, чем со стороны, где отсутствует слой соединительной ткани. Так как диффузия газов происходит с двух сторон мембраны, то средняя взвешенная толщина диффузионного барьера в самом тонком месте составляет 0,6 мкм. Диффузионный барьер включает в себя также сурфакгановую пленку на поверхности альвеолы и слой плазмы между стенкой капилляра и эритроцитами.
Выходу жидкости из капилляров препятствуют низкое давление в малом круге кровообращения (в б раза ниже, чем в системном кровотоке) и напряжение миофибробластов в интерстициальном пространстве. Последние контролируют комплайенс межклеточного пространства интеральвеолярных перегородок, повышая межклеточное давление и препятствуя тем самым экссудации.
Эпителиоциты типа II (пневмоциты типа II) рассеяны между клетками эпителия типа I. Их излюбленная локализация - в межкапиллярных петлях. Пнев- моциты типа II составляют 60-66% всех клеток альвеолярного эпителия, но покрывают только 7% поверхности альвеол. Пневмоциты типа II имеют округлую форму, цитоплазма сконцентрирована апикально. На верхушке клетки венчиком, окружая гладкое пространство, расположены микроворсинки, так что поверхность клетки напоминает тонзуру католического монаха. Пневмоциты типа II выполняют две важные биологические задачи. Во-первых, они являются стволовыми клетками для всех клеток альвеолярного эпителия. Во-вторых, они вырабатывают фосфолипиды и протеины сурфактанта.
Сурфактант - макромолекулярный комплекс фосфолипидов и гидрофобных протеинов. Наиболее крупные фосфолипидные компоненты - фосфатидилхо- лин (лецитин) и фосфатидилглицерол. Накопление лецитина в амниотической жидкости является показателем зрелости лёгкого и наличия достаточно большого количества сурфактанта для обеспечения спонтанного дыхания. До 32-й недели беременности, т.е. до образования альвеол, концентрация в амниотической жидкости лецитина (фосфатидилхолина) как показателя синтеза сурфактанта низкая (<3 мг%). С 32-й недели беременности концентрация лецитина в амниотической жидкости начинает резко увеличиваться. Лёгкое достигает зрелости при концентрации лецитина 10 мг%.
Синтез сурфактанта повышен в физиологических условиях у плодов женского пола, в патологических - при диабете матери, артериальной гипертензии, мальнутриции, токсемии, наркомании, предлежании плаценты, преждевременном разрыве плодного пузыря, задержке внутриутробного развития плода, гемоглобинопатии.
Синтез сурфактанта снижен в физиологических условиях у плодов мужского пола, в патологических - у престарелых беременных, при анемии, многоводии, гипотиреозе, изоиммунной болезни плода, болезнях печени и/или почек, сифилисе, токсоплазмозе.
Сурфактант образует поверхностно активную плёнку на внутренней поверхности лёгкого. Наряду с водной гипофазой он увлажняет эпителий, тем самым сохраняя его, и, самое главное, блокирует коллабирующее влияние поверхностного натяжения. Расправление легкого после рождения и его последующая стабильность возможны только при минимальном поверхностном натяжении. Одновременно сурфактант содействует уменьшению объёма лёгкого при выдохе. Чем больше заполнение альвеолы газом и, соответственно, увеличение её объёма, тем выше поверхностное натяжение. В максимально наполненной альвеоле плёнка сурфактанта истончена и не способна выдержать значительно наросшее поверхностное натяжение. Поверхностное натяжение внутренней поверхности альвеол существенно дополняет мышечный компонент выдоха. Лёгкое начинает спадаться до определённого объема, поверхностное натяжение падает, пленка сурфактанта утолщается и тормозит Дальнейшее коллабирование лёгкого. Снижение поверхностного натяжения при выдохе - эффективный механизм экономии механической энергии лёгкого.
Соединительная ткань лёгкого. Первые хрящи трахеи появляются на 4 неделе гестации, в главных бронхах - на 10-й неделе, в сегментарных - на 12-й неделе внутриутробного развития. На периферии лёгкого хрящи продолжают формироваться до 2 месяца после рождения ребёнка. Начиная с 3 месяца по- стпартальной жизни, число хрящей увеличивается очень незначительно, но существенно увеличиваются размеры и масса каждой хрящевой пластинки. В соединительной ткани собственно лёгкого условно выделяют 3 части:
Перибронхиальная и периартериальная соединительная ткань известна как аксиальная. Она окутывает бронхиальное дерево и лёгочную артерию. Аксиальная соединительная ткань всегда располагается в центре сегмента и оканчивается на уровне входа в альвеолу, где она контактирует с септальной соединительной тканью. Аксиальная соединительная ткань, наряду с коллагеновыми волокнами, содержит эластические волокна, доля которых возрастает к периферии. Соответственно меняется и биохимический состав хрящей. В проксимальной части бронхов хрящи гиалиновые, в мелких бронхах - эластические.
Периферическая соединительная ткань - покровная. Она сопровождает вены и лимфатические сосуды. Наиболее мощная покровная соединительная ткань образует висцеральную плевру и построена из 3 слоёв. Наружный слой плотных коллагеновых и эластических волокон является своеобразной капсулой для долей лёгкого. Средний слой плевры более рыхлый и несёт в себе кровеносные и лимфатические сосуды. От внутреннего плотного слоя в паренхиму легкого тянутся отдельные пучки, которые соединяются с межальвеолярными перегородками.
Септальная соединительная ткань - несущий каркас межальвеолярной перегородки. Она содержит большое количество эластических волокон и тесно связана с капиллярной сетью.
Все три компонента соединительной ткани лёгкого образуют единый комплекс. Септальная соединительная ткань связывает аксиальную и периферическую. Она сопрягает механическое напряжение между дыхательными путями и плеврой. В области альвеол эластические волокна лёгочного комплекса соединительной ткани принимают на себя приблизительно треть общей ретракцион- ной силы лёгких.
Межклеточный матрикс обеспечивает поддержку структур лёгкого и участвует в морфогенезе. Объём межклеточного матрикса резко увеличивается при бронхолёгочной дисплазии и дистресс синдроме новорождённых. В лёгких у таких детей существенно увеличивается концентрация ДНК, гидроксипролина и дес- мозина (J. Vesbo е.а., 1996).
Лёгкие снабжаются кровью из двух разных систем кровообращения.
Лёгочный круг кровообращения. Аа. pulmonales - результат деления Truncus pulmonalis на правую и левую лёгочные артерии. Они несут обеднённую кислородом кровь из правого предсердия в лёгкое. Кровь оксигенируется в капиллярах межальвеолярных перегородок и через Vv. pulmonales поступает в левое предсердие. Эта система кровообращения (малый круг кровообращения) служит для обеспечения организма кислородом и известна как Vasa publica.
Кровоснабжение собственно лёгких как органа через большой круг кровообращения проходит по т.н. бронхиальному кругу. Rr. bronchiales, ранее известные как Аа. bronchiales, и Vv. bronchiales являются артериями мышечного типа, принадлежат к большому кругу кровообращения и снабжают участки лёгкого, которые не получают непосредственно оксигенированную кровь из системы Vasa publica. Это относится к тканям лёгочной артерии, бронхов и бронхиол до терминальных включительно, перибронхиальным и периартериальным тканям. Rr. bronchiales располагаются в соединительной ткани перибронхиально. К каждому легкому подходит 1-3 Rr. bronchiales, ответвляющихся от 3-4 межрёберных артерий или непосредственно от аорты. Капиллярная сеть этих артерий вливается в W. bronchiales, откуда кровь через два коротких ствола вблизи ворот лёгкого вливается в V. azygos et V. hemiazygos. На периферии лёгкого Vv. bronchiales впадают в Vv. pulmonales. А области мелких бронхов существуют анастомозы между Rr. bronchiales и A. pulmonalis. Эта связь между малым кругом кровообращения и большим кругом контролируется мощными запирательными артериями. В норме они сокращены, и кровь в них не циркулирует. Если центральные области лёгкого не вентилируются, запирательные артерии открываются, и восстанавливается минимальный жизненно сохраняющий кровоток через систему большого круга кровообращения.
Респираторные бронхиолы, альвеолярные ходы, соединительнотканные перегородки, субплевральные ткани получают оксигенированную кровь через систему Vasa publica.
Лёгочная артерия, A. pulmonalis, сопровождает бронхиальное дерево до респираторных бронхиол. A. pulmonalis входит в лёгкое в области ворот, вентрально перекрещивает главный бронх. Её ветви располагаются в рыхлой перибронхиальной соединительной ткани и располагаются в центре сегментов лёгкого. Расположение артерии в рыхлой соединительной ткани позволяет ей смещаться придыхании. Тонкая стенка обеспечивает низкое давление крови. Ветви A. pulmonalis вплоть до 7-го порядка эластического типа. Стенки артерий эластического типа характеризуются мощным эластическим каркасом и развитым мышечным слоем. Мелкие ветви A. pulmonalis диаметром 2-3 мм построены по мышечному типу. Их тонкая стенка позволяет изменять диаметр артерии соответственно глубокому дыханию или увеличивать диаметр при увеличении минутного объёма сердца и повышении давления крови. Терминальные ветви лёгочной артерии располагаются между альвеолярными ходами и продолжаются в капилляры, окружающие альвеолы. Обычно терминальные ветви начинаются в конце респираторных бронхиол, но могут ответвляться под острым углом от основного ствола и раньше. Терминальные ветви A. pulmonalis известны в литературе как «бесчисленные артерии» («supernumerary arteries»). Между ветвями A. pulmonalis нет функционально значимых анастомозов. Поэтому блокада кровотока по артерии ведёт к инфаркту лёгкого. Кровоснабжение участка лёгкого зависит от его аэрации. Локальное снижение парциального давления кислорода приводит к местной ва- зоконстрикции и снижению кровотока через плохо аэрируемый участок.
Мышечные клетки в стенке внутрилёгочных сосудов появляются не ранее 20 недели гестации. К моменту рождения сосуды с мышечным компонентом стенки не достигают даже устья терминальных бронхиол. К терминальным бронхиолам такие сосуды подходят только на 4 месяце жизни. Мышечные элементы в стенках сосудов альвеолярных ходов появляются не ранее 3-4 годов жизни. Вокруг альвеол такие сосуды появляются только к 19 годам. Т.е. ребёнок оказывается защищён от спазма сосудов, непосредственно участвующих в газообмене.
Лимфатическая система лёгкого ориентирована на три компонента единой лёгочной соединительнотканной системы. Лимфатические сосуды начинаются в аксиальной и периферической соединительной ткани, но их нет в межальвеолярных перегородках. Внеклеточная жидкость межальвеолярных перегородок по септальной соединительной ткани переносится со скоростью 4-7 мл/ час в лимфатические сосуды аксиальной и периферической соединительной ткани. Лимфатические сосуды периферической соединительной ткани располагаются в висцеральной плевре и в соединительно-тканных перегородках, образуя густую нерегулярную трёхразмерную сеть. В области ворот лёгкого они сливаются с перибронхиальными и периартериальными лимфатическими сосудами. Перибронхиальные и периартериальные лимфатические сосуды начинаются как лимфатические капилляры в соединительной ткани проксимальных бронхиол и в дальнейшем проходят в центре сегментов, сетеобразно обвивая бронхи и артерии. Только в области ворот лёгкого в лимфатических сосудах появляется тонкий слой продольно расположенных гладкомышечных волокон. В области перехода от сегментарных к долевым бронхам появляются первые лимфатические узлы (Nn. lymphatidintrapulmonales). Отсюда лимфа через лимфатические узлы главных бронхов, бифуркации и трахеи попадает в Truncus bronchomediastinalis и Truncus bronchomediastinalis anterior. Ниже главных бронхов существует дополнительный канал оттока непосредственно в Ductus thoracicus. Часть поверхностно расположенных лимфатических сосудов базальных отделов лёгкого через Ligamentum pulmonale впадает непосредственно в Ductus thoracicus. Через лимфатические сосуды Ligamentum pulmonale лимфатическая система лёгких непосредственно связана с лимфатическими узлами брюшной полости. Этот путь с точки зрения распространения инфекции особенно актуален для детей.
Нервы лёгкого закладываются из эктодермы. Из нервной пластинки клетки мигрируют в стенку будущей трахеи и закладку лёгкого ещё до отделения трахеи от пищевода. На б неделе гестации уже можно определить симпатическую и парасимпатическую систему. Иннервация лёгких осуществляется через блуждающий нерв и симпатический ствол, ветви которых образуют на главных бронхах Plexus pulmonalis. Сплетение распространяется далее по бронхам и сосудам. Веточки к висцеральной плевре отходят непосредственно от ворот лёгкого. Эфферентные холинергические волокна обеспечивают мускулатуру бронхов, бронхиол, сосудов, а также слизистые железы и бокаловидные клетки. Эти же структуры иннервируются адренергическими эфферентными симпатическими волокнами. Афферентные волокна проходят в стволе блуждающего нерва и начинаются в рецепторах, расположенных в бронхиолах, бронхах и трахее и воспринимающих боль, растяжение и раздражение. Висцеральная плевра не сбдержитболевых рецепторов, и боль, возникающая, например, при плевритах, обусловлена раздражением рецепторов париетальной плевры. Стимуляция симпатических нервов ведёт к расширению дыхательных путей. Стимуляция парасимпатических - к сокращению мускулатуры бронхов и бронхиол, усиленной секреции слизистых желёз и бокаловидных клеток, расширению сосудов. Число нервов, обеспечивающих спазм бронхов, уменьшается после 3 лет жизни. Одновременно снижается бронхоспастический ответ на гистамин и метахолин.
Р-адренорецепторы и рецепторы для вазоактивного интестинального пептида появляются на эпителии лёгких, зачатках бронхов и в лёгочной артерии на 14 неделе внутриутробной жизни и их число существенно увеличивается на первом году жизни, а-1-адренорецепторы и мускариноподобные рецепторы появляются только на 23-24 неделях гестации.
Развитие лёгких приводит к тому, что они полностью заполняют правую и левую плевральные полости. Границы полостей определяются грудной клеткой, средостением и диафрагмой. С медиальной стороны лёгких появляется кардиальная ниша. Так как сердце расположено в основном слева, левое лёгкое на 10-207о меньше, чем правое. Разветвление бронхов и лёгочной артерии служат основанием для выделения долей, сегментов, долек и ацинусов. Левое лёгкое делится на 2, правое - на 3 доли. Доли отделяются друг от друга тонкими щелями (Fissurae horizontales et obliguae), простирающимися едва ли не до ворот легкого и образованными глубоким внедрением в паренхиму висцеральной плевры. Сегменты лёгкого имеют форму пирамид или шариков, верхушки которых направлены к воротам лёгкого. Сегментарные бронхи и артерии входят в верхушку сегмента, распространяются по центру. Вены расположены в соединительной ткани на поверхности сегмента. Соединительнотканный покров сегментов не сплошной и не образует абсолютной границы с другими сегментами. Дольки лёгкого разграничиваются тонкой соединительной тканью и образуют характерный полигональный рисунок костальной и диафрагмальной поверхности лёгкого. Считается, что дольки определяются бронхиолой первого порядка и начинаются в области перехода от бронхов к бронхиолам. Ацинус * область газообмена, определяемая терминальной бронхиолой или респираторной бронхиолой первого порядка. Дальнейшее деление указанных воздухопроводящих путей определяет объём ацинуса в пределах их 6-7 генераций, но может достигать 12. Так как собственно воздухопроводящие пути завершаются на уровне терминальных бронхиол, сумма ацинусов образует общий объём, где происходит газообмен.
В мире всё построено по высшему разуму: логично и целесообразно. И если мы этого не видим, то только потому, что не знаем. Анатомия и гистология лёгких полностью подчинены их функциональным задачам по оксигенированию крови и удалению углекислого газа. После рождения происходит смена типа оксигенации: трансплацентарный путь чрезвычайно быстро сменяется на диффузионный лёгочный. Как было сказано ранее, первые дыхательные движения зарегистрированы у 7-месячных плодов. Эти движения существенно определяют рост и развитие лёгкого. Внутриутробные дыхательные движения появляются только периодически и блокируются гипоксией. Постпартально организм попадает в условия свободного поступления большого объёма кислорода, но одновременно в 3 раза возрастают энергетические затраты. Происходит переключение периферических рецепторов на высокий уровень ра02 и переход нерегулярных дыхательных движений в постоянные. Пусковыми моментами постпартальных изменений регуляции дыхания является снижение температуры тела и повышение раС02. Начинается функционирование лёгких.
Функция лёгких определяется регуляцией дыхания. Задачи регуляции дыхания - поддержание стабильности парциального давления кислорода и углекислого газа в артериальной крови вне зависимости от потребления кислорода или образования углекислого газа. Регуляция осуществляется путём создания классического замкнутого круга. Существует центр регуляции, сенсорный (центральные и периферические хеморецепторы, механорецепторы) и эффектор- ный (дыхательная мускулатура) аппараты.
Центральный аппарат регуляции дыхания располагается в продолговатом мозге близ Nucleus ambiguus и Nucleus tractus solitaruis, продолжаясь в некоторые отделы моста мозга. Центр регуляции дыхания представляет собой сеть нейронов. Здесь находятся центральный генератор ритма и различные типы нейронов, активируемые или угнетаемые комплексом нейрорегуляторов и нейротрансмиттеров. Нейроны дыхательного центра иннервируют через двигательные нейроны спинного нерва дыхательную мускулатуру и, за счёт связи с другими центрами головного мозга, синхронизируют дыхание и тонус мышц языка, гортани, глотки, бронхов. Это позволяет снизить сопротивление потоку воздуха на вдохе.
Дыхательные рецепторы подразделяются на хеморецепторы и механорецепторы. Хеморецепторы подразделяются на центральные и периферические и реагируют на изменение химических компонентов крови и ликвора.
Центральные хеморецепторы находятся непосредственно в нейронной сети респираторного центра и на вентральной поверхности продолговатого мозга. Они являются самыми чувствительными и реагируют на повышение концентрации протонов водорода во внеклеточной жидкости и в ликворе. При гиперкапнии углекислый газ усиленно диффундирует через гематоэнцефалитический барьер, вытесняет ионы водорода, которые стимулируют центральные хеморецепторы. Углекислый газ диффундирует в 20 раз легче, чем кислород. Поэтому даже небольшие изменения раС02 вызывают существенные изменения частота и глубины дыхания.
Периферические хеморецепторы находятся в области разветвления общей сонной'артерии на внутреннюю и наружную (Glomus caroticum), в дуге аорты (GLomera aortica) и в правой подключичной артерии. Они иннервируются через N. glossophanngeus и N. laringeus, отвечая на гипоксию, в меньшей степени - на ацидоз и гиперкапнию. Периферические хеморецепторы очень хорошо кровоснабжаются (20 мл/г/мин). Артериовенозная разница напряжения кислорода в этих структурах минимальна. Поэтому они реагируют на изменение артериального р02. Порог раО^ за которым начинается активация рецепторов, составляет 110 мм рт.ст. То есть они отвечают на колебания ра02 при обычном дыхании, а скорость ответа позволяет им реагировать на колебания ра02 в пределах обычного дыхательного цикла.
Механорецепторы расположены в гладкой мускулатуре дыхательных путей. При растяжении стенок бронхов раздражение механорецепторов приводит к активации блуждающего нерва и блокаде вдоха, что предотвращает перерастя- жение лёгкого. Этот рефлекс получил название рефлекса Геринга-Броера. Он особенно активен у детей первых месяцев жизни, когда при глубоком вдохе возможно апноэ. У детей старшего возраста и взрослых рефлекс проявляется только при объеме вдоха, превышающем 1 литр. Но даже в этом случае апноэ не развивается, отмечается только уменьшение глубины и частоты дыхания.
К механорецепторам принадлежат также ирритационные рецепторы (рецепторы С и J). С-рецепторы находятся в эпителии трахеи и бронхов. Они активируются газами, дымом, пылью, холодным воздухом. При раздражении С-рецеп- торов развивается спазм бронхов, кашель, одышка и брадикардия. У детей грудного возраста, а у взрослых - во сне, раздражение С-рецепторов может вести не к кашлю, а к апноэ. J-рецепторы находятся в стенках капилляров и отвечают на увеличение объёма крови или интерстициальной жидкости. Их раздражение приводит к тахидиспное, а при перераздражении - к остановке дыхания. J-рецепторы приобретают особое клиническое значение при пневмонии, отёке лёгких или интерстициальных заболеваниях.
В носоглотке находятся механорецепторы, ответственные за чихание, кашель и бронхоконстрикцию. Клиническое значение имеют рецепторы гортани, реагирующие на химические и механические раздражители. Особенно активны эти рецепторы у новорождённых. Их активация молоком, кислым содержимым желудка, при интубации может привести к остановке дыхания, брадикардии и повышению давления в малом круге кровообращения.
Под термином «дыхательная мускулатура» объединяют межрёберные мышцы, мышцы брюшной стенки и диафрагму. Эффективное дыхание требует координации работы всех указанных мышечных групп. Ноу новорождённых (прежде всего) и во время сна в фазу быстрого движения глазных яблок (REM, фаза быстрого сна) эта координация нарушается. При этом развивается парадоксальное дыхание, когда инспираторное сокращение диафрагмы совпадает с экспираторным движением межрёберных мышц.
Интегрированная регуляция дыхания оказывается значительно сложнее, чем механически понятое взаимодействие дыхательного центра, рецепторов и дыхательной мускулатуры. Каждый из указанных компонентов подвергается влиянию многих факторов (возраст, степень зрелости ребёнка, бодрствование или сон, наличие заболеваний и т.д.)
Повышение раС02 ведёт к быстрому увеличению объёма вдоха (тидалевский объём). При недостаточной компенсации увеличивается и частота дыхания. Если раС02 повышается во сне, запускается реакция пробуждения. В фазу медленного сна (медленное движение глазных яблок - Non-REM) пробуждение происходит быстро, в фазу REM - медленнее. Относительное увеличение минутного объёма дыхания (тидалевский объём, тидалевское пространство) нарастает с возрастом. У взрослых повышение раС02 на 1 мм рт.ст. приводит к приросту минутного объема дыхания на 1-2 л/мин. Но очень быстро развивается адаптация, и у пациентов с хроническими заболеваниями лёгких с гиперкапнией дыхание регулируется гипоксией, а не гиперкапнией. Поэтому при даче им кислорода и, соответственно, быстром снятии гипоксии, возможно развитие выраженной гиповентиляции.
При физиологическом уровне раС02 снижение ра02 ниже 50-60 мм рт.ст. у детей и взрослых так же, как и гиперкапния, вызывает повышение минутного объёма дыхания. Но, в противоположность гиперкапнии, минутный объём дыхания повышается не так стремительно. Если одновременно существует и гиперкапния, минутный объём дыхания нарастает существенней и быстрее по времени. Однако у детей, живущих с рождения в условиях гипоксии (пороки сердца синего типа, хронические заболевания лёгких, условия высокогорья), эта реакция угнетена. Гипоксия, возникшая во сне, как и гиперкапния, вызывает пробуждение. Но у новорождённых и детей грудного возраста реакция пробуждения запаздывает. При длительно существующей гипоксии меняется «архитектоника» сна: фазы Non-REM урежаются, нарастает длительность и частота фаз REM. Сон становится поверхностным, прерывистым, полным кошмарных снов.
У плодов, недоношенных и новорождённых (особенно незрелых) реакция на гипоксию полностью отличается от таковой у более старших детей и взрослых. Снижение ра02 первоначально приводит, как и у более зрелых субъектов, к повышению минутного объёма дыхания. Но через минуту-другую включается центральный механизм угнетения дыхания вплоть до полного апноэ. Одновременно резко падает потребление кислорода тканями, голосовая щель спазми- руется, задерживая воздух в лёгких. И здесь мы видим механизм целесообразности. В условиях внутриутробного существования гипоксия не может быть исправлена регуляцией собственно дыхания. Дыхательные движения требуют больших энергетических затрат, которые не обеспечиваются сниженной трансплацентарной диффузией кислорода. Но после рождения, особенно у недоношенных, этот механизм ответа на гипоксию может привести к серьёзным нарушениям дыхания. У недоношенных детей порог гипоксии, за которым начинается неравномерное дыхание, на 10-20 мм рт.ст. выше, чем у доношенных и взрослых, и достигает 60-70 мм рт.ст.
У детей более старшего возраста и у взрослых в качестве реакции на гипоксию развивается физиологическое дыхание под постоянным повышенным давление на выдохе (ППДВ). Оно проявляется резким глубоким вдохом с медленным выдохом и последующей паузой. ППДВ развивается при снижении ра02 на 10 мм ниже нормы (исходной) независимо от pH крови или раС02. ППДВ - закономерная физиологическая реакция на асфиксию, которая проявляется первичной гипервентиляцией, затем первичным апноэ и ППДВ (30- 60 мин у новорождённых и 2-3 мин у взрослых). При сохраняющейся глубокой гипоксии развивается терминальное апноэ. ППДВ - действенный механизм самооживления и его нарушение у детей может быть одной из причин внезапной смерти.
На регуляции дыхания сказываются различные фазы сна. В фазу REM ра02 низкое, дыхание нерегулярное, дыхательные движения, особенно у недоношенных, парадоксальные, паузы в дыхании часты и длительны. Частота дыхательных движений выше, чем в фазу Non-REM, но объём вдоха ниже, поэтому минутный объём дыхания несущественно выше, чем в фазу Non-REM. В фазу REM у недоношенных каждые две минуты отмечаются вздохи, которые призваны возобновить вентиляцию в коллабированных участках лёгкого. В фазу Non-REM дыхание регулярное, апноэ и парадоксальное движение наблюдаются редко, ра02 выше, чем в фазу REM. В первые три месяца после рождения частота эпизодов Non-REM сна уменьшается и в дальнейшем остаётся стабильной на протяжении всей жизни, составляя 40-45% в общей длительности сна.
Периодическое дыхание (дыхание Чейн-Стокса) - чередование вдохов и коротких (4-10 сек) перерывов в дыхании. Недоношенные проводят 50% своего сна в состоянии периодического дыхания. Периодическое дыхание рассматривается как физиологическое у доношенных новорождённых и детей первых месяцев жизни. У взрослых периодическое дыхание наблюдается во сне при гипоксии, например, в условиях высокогорья. Патофизиология этого типа дыхания ещё не изучена. Существует мнение, что периодическое дыхание обусловлено сочетанием высокой чувствительности периферических хеморецепторов и низким содержанием кислорода в лёгких. Низкое содержание кислорода в легких ведёт к периодической активизации хеморецепторов.
Газообмен в лёгких осуществляется только за счёт разницы парциального давления газов по обе стороны диффузионного барьера. Становление газообмена полностью коррелирует с анатомическим и функциональным развитием лёгкого. При обструкции периферических бронхов аэрация соответствующей области лёгкого облегчается дополнительными каналами между альвеолами (коновские поры) и возникновением соустий между бронхиолами и ацинусами соседних групп за счёт открытия стенок альвеол (каналы Ламберта). Коновские поры появляются к 2 годам жизни, ламбертовские каналы - к 7. Отсутствие этих дополнительных каналов у новорождённых и детей грудного и младшего возраста повышает вероятность вентиляционно-перфузионных нарушений. При интерстициальных заболеваниях лёгких гипоксия никогда не возникает только за счёт нарушений диффузионного барьера* альвеолярно-капиллярного блока. Одновременно возникают внуфилёгочные шунты и нарушения региональной вентиляции.
Стабильность газообмена во многом обеспечивается сохранением некоторого объёма газа в лёгких после выдоха (до 30 мл/кг массы тела). Этот объём называется функциональной остаточной ёмкостью и является резервуаром кислорода, препятствующим десатурации крови в экспировавшем лёгком. У детей старшего возраста и взрослых объём воздуха, сохраняющегося в лёгких после выдоха, поддерживается равновесием между эластичностью лёгких и стабильностью грудной клетки. Указанный объём воздуха достигает 29-40% общего объёма лёгкого в положении лёжа и 50% - в положении стоя. У новорождённых оссификация костей не завершена, стабильность грудной клетки низкая. В то же время ретракционная сила лёгких при пересчёте на единицу объёма близка к таковой у взрослых. При расчёте теоретически ожидаемого в этих условиях остаточного объёма лёгких он должен составлять у новорождённых всего 10% от общей ёмкости лёгких. Такой объём при каждом выдохе создавал бы для новорождённого реальную опасность тяжёлой гипоксии. В действительности объём воздуха в лёгких после выдоха составляет у новорождённых 40% от общей ёмкости лёгких (30 мл/кг массы тела), хотя у недоношенных этот объём существенно ниже. Сохранение у новорождённых такого большого объёма воздуха, играющего роль буфера, достигается сокращением голосовых складок с торможением выдоха (включается механизм дыхания под постоянным положительным давлением) и ранней активацией дыхательной мускулатуры. Все это уравновешивает нестабильность грудной клетки. Но всякое угнетение центральной нервной системы (незрелость, тяжёлое заболевание, наркоз) ведёт к нарушению описанного компенсаторного механизма и повышению вероятности гипоксии.
Далеко не весь объём вдоха участвует в газообмене. Часть ингалированного воздуха попадает в анатомическое мёртвое пространство, т.е. в отделы лёгкого, не имеющие альвеолярного эпителия. Другая часть объёма вдоха попадает в неперфузируемые альвеолы (альвеолярное мёртвое пространство). Альвеолярное мёртвое пространство вместе с анатомическим мёртвым пространством образуют физиологическое мёртвое пространство. Наконец, только оставшаяся часть ингалированного воздуха достигает перфузируемых альвеол и участвует в газообмене. У здорового недоношенного (насколько недоношенный может быть здоровым) физиологическое мёртвое пространство достигает 41-43% объёма Ингалированного воздуха (тидалевского объёма). При остром респираторном дистресс-синдроме, рестриктивных заболеваниях лёгких, дистресс-синдроме новорождённых доля физиологического мёртвого пространства составляет 70% и более от тидалевского объёма.
Нормальный процесс вдоха-выдоха использует средние лёгочные объёмы, не достигая ни остаточного объёма, ни общей ёмкости лёгких. Остаточный объём (00) - это объём газа в лёгких в конце максимального выдоха. Общая ёмкость лёгких (ОЕЛ) - объём газа в лёгких в конце максимального вдоха. Жизненная ёмкость - разница между общей ёмкостью и остаточным объёмом.
Следующим этапом газообмена является перфузия. Перфузия альвеол осуществляется через артерии лёгких, распространяющиеся вдоль бронхиального дерева и продолжающиеся в преацинарные артерии. Существуют артерии, обеспечивающие дополнительную перфузию артерий и не распространяющиеся по бронхиальному дереву. Они предназначены для коллатерального кровообращения. Кроме того, 1% минутного объёма сердца поступает к лёгким через бронхиальные ветви аорты. Между бронхиальными артериями и лёгочными артериями существуют анастомозы, которые получили название множественных аор- то-лульмональных коллатералей. В норме кровоток через них минимален, клиническое значение они приобретают при врождённых пороках, затрудняя их коррекцию. У взрослых мышечные артерии простираются до субплевральных областей, у новорождённых они кончаются на уровне терминальных бронхиол и не достигают регионов газообмена. Физиологическое соответствие вентиляции и кровотока поддерживается анатомическими механизмами и локальным
сокращением лёгочных сосудов в плохо вентилируемых участках. За счёт открытия сосудов в прежде плохо вентилируемых участках кровоток в лёгком может возрасти в 4,5-5,5 раз. Но если сосуд начинает функционировать в плохо вентилируемом участке, т-е. физиологическая вазоконстрикция терпит крах, кровь, возвращающаяся из этих участков, не оксигенирована. Появляется внут- рилёгочный шунт с гипоксией. Нарушения соответствия вентиляции и перфузии имеет особое значение для развития гипоксемии у детей, в то время как у взрослых в качестве причин гипоксии преобладают нарушения диффузии.
У новорождённого парциальное напряжение кислорода в артериальной крови значительно ниже, чем у взрослого, т.е. альвеолярно-капиллярный градиент по кислороду повышен. Это объясняется право-левым шунтом, дис- и ателектазами не успевшего ещё адаптироваться лёгкого. Оксигенация достигает показателей взрослого только к 7 году жизни.
Таким образом, лёгкие - особый, сложно устроенный, глубоко интегрированный в структуры организма жизненно важный орган. Он настолько важен, что мы им не управляем. Мы контролируем работу кишечника, мочевого пузыря, мышц. Мы можем им сказать: «Не двигаться!». Но мы не можем задержать функцию лёгких. Единственно, что мы можем им сказать: «Двигаться. Двигаться! Дышать!!!».
